Byetta za liječenje dijabetesa
Naziv marke: Byetta
Generičko ime: Exenatide
Oblik doziranja: injekcije
Sadržaj:
Opis
Klinička farmakologija
Kliničke studije
Indikacije i upotreba
kontraindikacije
Mjere opreza
Nuspojave
predoziranje
Doziranje i primjena
skladištenje
Kako se isporučuje
Informacije o pacijentu Byetta (Exenatide) (na običnom engleskom)
Opis
Byetta® (exenatide) je sintetički peptid koji ima inkretinsko-mimetičko djelovanje i prvotno je identificiran u gušteru Heloderma suspectum. Byetta pojačava lučenje inzulina ovisnog o glukozi beta-stanicama gušterače, suzbija neprimjereno povišenu sekreciju glukagona i usporava pražnjenje želuca. Exenatid se razlikuje u kemijskoj strukturi i farmakološkom djelovanju od inzulina, sulfonilureje (uključujući D-fenilalaninski derivati i meglitinidi), biguanidi, tiazolidindioni i alfa-glukozidaza inhibitori.
Exenatid je peptid amida aminokiseline od 39 'amina. Exenatid ima empirijsku formulu C184H282N50O60S i molekulska masa 4186,6 Daltona. Slijed aminokiselina za exenatide prikazan je dolje.
H - Njegov - Gli - Glu - Gli - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta se isporučuje za potkožno (SC) ubrizgavanje kao sterilna, očuvana izotonička otopina u staklenom ulošku sastavljenom u injektor (olovku) za olovku. Svaki mililiter (mL) sadrži 250 mikrograma (mcg) sintetičkog eksenatida, 2,2 mg metakrezola kao antimikrobnog konzervansa, manitola kao sredstva za podešavanje toničnosti, i ledena octena kiselina i natrijev acetat trihidrat u vodi za injekcije kao puferska otopina pri pH 4,5. Dostupne su dvije napunjene olovke za dostavu jedinične doze od 5 mcg ili 10 mcg. Svaka napunjena olovka isporučit će 60 doza za 30 dana davanja dva puta dnevno (BID).
vrh
Klinička farmakologija
Mehanizam djelovanja
Incretini, poput peptida sličnog glukagonu-1 (GLP-1), pojačavaju lučenje ovisnog o glukozi i pokazuju druga antihiperglikemijska djelovanja nakon puštanja u cirkulaciju iz crijeva. Exenatide je inkretinski mimetički agens koji oponaša povećanje lučenja inzulina ovisnog o glukozi i nekoliko drugih antihiperglikemijskih djelovanja inkretina.
Aminokiselinski slijed eksenatida djelomično se preklapa s ljudskim GLP-1. Pokazano je da Exenatide veže i aktivira poznati humani GLP-1 receptor in vitro. To dovodi do povećanja sinteze inzulina ovisne o glukozi i in vivo izlučivanja inzulina iz beta stanica gušterače, pomoću mehanizama koji uključuju ciklični AMP i / ili drugu unutarćelijsku signalizaciju putevi. Exenatid potiče oslobađanje inzulina iz beta stanica u prisutnosti povišene koncentracije glukoze. Kada se primjenjuje in vivo, exenatid oponaša određena antihiperglikemijska djelovanja GLP-1.
Byetta poboljšava kontrolu glikemije smanjujući koncentraciju glukoze na testu i postprandijalnu bolest kod pacijenata s dijabetesom tipa 2 kroz niže opisane akcije.
Izlučivanje inzulina ovisno o glukozi: Byetta ima akutne učinke na reakciju beta-stanica gušterače na glukozu i dovodi do oslobađanja inzulina samo u prisutnosti povišene koncentracije glukoze. Ovo izlučivanje inzulina opada kako se koncentracije glukoze u krvi smanjuju i približavaju euglikemiji.
Odgovor inzulina u prvoj fazi: U zdravih osoba, snažna sekrecija inzulina pojavljuje se tijekom prvih 10 minuta nakon intravenskog (IV) unosa glukoze. Taj sekret, poznat kao "odgovor na inzulin prve faze", karakteristično odsutan kod pacijenata s dijabetesom tipa 2. Gubitak reakcije na inzulin iz prve faze je rani defekt beta-stanica kod dijabetesa tipa 2. Primjena Byetta u terapijskim koncentracijama u plazmi obnavljala je reakciju inzulina iz prve faze na IV bolus glukoze u bolesnika s dijabetesom tipa 2 (slika 1). I izlučivanje inzulina iz prve faze i izlučivanje inzulina u drugoj fazi značajno su povećane u bolesnika s dijabetesom tipa 2 liječenih Byettom u usporedbi s fiziološkom otopinom (p
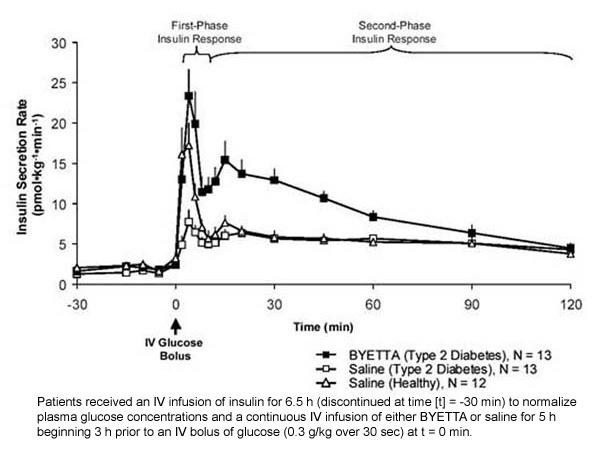
Slika 1: Srednja (+ SEM) brzina izlučivanja inzulina tijekom infuzije Byette ili fiziološke otopine u bolesnika s dijabetesom tipa 2 i tijekom infuzije fiziološke otopine u zdravih osoba
Izlučivanje glukagona: U bolesnika s dijabetesom tipa 2, Byetta moderira lučenje glukagona i smanjuje koncentraciju glukagona u serumu tijekom razdoblja hiperglikemije. Niže koncentracije glukagona dovode do smanjene proizvodnje glukoze u jetri i smanjene potrebe za inzulinom. Međutim, Byetta ne smanjuje normalan odgovor glukagona na hipoglikemiju.
Pražnjenje želuca: Byetta usporava pražnjenje želuca, smanjujući na taj način brzinu pojave glukoze dobivene u obroku u cirkulaciji.
Unos hrane: I životinjama i ljudima pokazalo se da primjena eksenatida smanjuje unos hrane.
farmakokinetika
apsorpcija
Nakon primjene SC-a bolesnicima s dijabetesom tipa 2, eksenatid dostiže srednju vršku koncentracije u plazmi za 2,1 h. Srednja vršna koncentracija eksenatida (Cmaksimum) iznosila je 211 pg / mL, a ukupna srednja površina ispod krivulje (AUC0-inf) bila je 1036 pg-h / mL nakon davanja SC-om od 10 mcg doze Byette. Izloženost eksenatidu (AUC) proporcionalno se povećavala u rasponu terapijskih doza od 5 mcg do 10 mcg. Vrijednosti Cmax porasle su manje nego proporcionalno u istom rasponu. Slična izloženost postiže se primjenom SC Byetta u abdomen, bedro ili ruku.
Distribucija
Prosječni prividni volumen raspodjele exenatida nakon davanja SC-a jedne doze Byette iznosi 28,3 L.
Metabolizam i eliminacija
Neklinička ispitivanja pokazala su da se exenatid pretežno eliminira glomerularnom filtracijom s naknadnom proteolitičkom razgradnjom. Srednji prividni klirens exenatida u ljudi iznosi 9,1 L / h, a srednji terminalni poluživot je 2,4 h. Ove farmakokinetičke karakteristike exenatida ne ovise o dozi. U većini pojedinaca koncentracije exenatida mogu se mjeriti približno 10 sati nakon doze.
Posebne populacije
Bubrežna insuficijencija
U bolesnika s blagim i umjerenim oštećenjem bubrega (klirens kreatinina 30 do 80 ml / min), očistenje eksenatida bilo je samo blago smanjeno; stoga nije potrebno prilagođavanje doze lijeka Byetta u bolesnika s blagim do umjerenim oštećenjem bubrega. Međutim, u bolesnika s bubrežnom bolešću u završnom stadiju koji su primali dijalizu, prosječni klirens eksenatida smanjen je na 0,9 L / h u usporedbi s 9,1 L / h kod zdravih ispitanika (vidjeti MJERE OPREZA, Općenito).
Jetrna insuficijencija
Nije provedena farmakokinetička studija u bolesnika s dijagnozom akutne ili kronične jetrene insuficijencije. Budući da se exenatid čisti prvenstveno putem bubrega, ne očekuje se da jetrena disfunkcija utječe na koncentracije exenatida u krvi (vidi farmakokinetika, Metabolizam i eliminacija).
gerijatrijske
Populacijska farmakokinetička analiza bolesnika (u rasponu od 22 do 73 godine) sugerira da dob ne utječe na farmakokinetička svojstva exenatida.
pedijatrijski
Exenatide nije proučavan u pedijatrijskih bolesnika.
rod
Populacijska farmakokinetička analiza muških i ženskih pacijenata sugerira da spol ne utječe na distribuciju i eliminaciju exenatida.
utrka
Populacijska farmakokinetička analiza bolesnika, uključujući kavkaška, latinoamerička i crna, sugerira da rasa nema značajan utjecaj na farmakokinetiku exenatida.
gojaznost
Populacijska farmakokinetička analiza pretilih (BMI 30 kg / m2) i ne pretilih bolesnika sugerira da pretilost nema značajan utjecaj na farmakokinetiku exenatida.
Interakcije s lijekovima
digoksin
Istodobna primjena opetovanih doza Byette (10 mcg BID) smanjila je Cmaksimum oralnog digoksina (0,25 mg QD) za 17% i odgodio Tmax za otprilike 2,5 h; međutim, ukupna farmakokinetička izloženost ustaljenom stanju (AUC) nije promijenjena.
lovastatin
AUC lovastatina i Cmax smanjeni su otprilike 40% odnosno 28%, a Tmax se odgodio oko 4 sata kada je Byetta (10 mcg BID) primjenjivano je istodobno s jednom dozom lovastatina (40 mg) u usporedbi s davanim lovastatinom sama. U kontroliranim kliničkim ispitivanjima lijeka Byetta u trajanju od 30 tjedana, upotreba Byette u bolesnika koji su već primali HMG Inhibitori CoA reduktaze nisu bili povezani sa stalnim promjenama lipidnog profila u usporedbi s Osnovna linija.
lizinopril
U bolesnika s blagom do umjerenom hipertenzijom stabiliziranom na lizinopril (5 do 20 mg / dan), Byetta (10 mcg BID) nije mijenjao Cmax ili AUC lizinoprila u stanju ravnoteže. Lisinopril ustaljeno stanje Tmaksimum odgodio je 2 sata. Nije bilo promjena u prosječnom sistoličkom i dijastoličkom krvnom tlaku od 24 sata.
acetaminofen
Kada je davano 1000 mg acetaminofenskog eliksira sa 10 mcg Byette (0 h) i 1 h, 2 h, i 4 sata nakon injekcije Byette, AUC acetaminofen je smanjen za 21%, 23%, 24% i 14%; Cmaksimum smanjena je za 37%, 56%, 54%, i 41%; Tmaksimum povećana je s 0,6 h u kontrolnom razdoblju na 0,9 h, 4,2 h, 3,3 h, odnosno 1,6 h. AUC-Acetaminofen, Cmaksimum i Tmax nisu značajno promijenjene kada je davan acetaminofen 1 sat prije injekcije Byette.
varfarin
Istodobna primjena ponovljenih doza Byette (5 mcg BID u danima 1-2 i 10 mcg BID u danima 3-9) kod zdravih dobrovoljaca, odgodila je varfarin (25 mg) Tmax za oko 2 sata. Nisu primijećeni klinički značajni učinci na Cmax ili AUC S- i R-enantiomera varfarina. Byetta nije promijenila farmakodinamička svojstva (procijenjena prema INR odgovoru) varfarina.
farmakodinamiku
Postprandialna glukoza
U bolesnika s dijabetesom tipa 2, Byetta smanjuje postprandijalnu koncentraciju glukoze u plazmi (Slika 2).
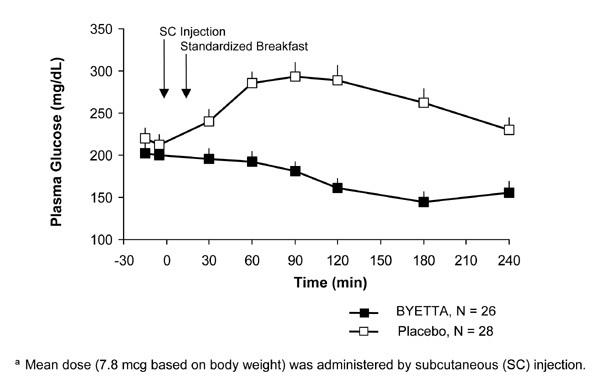
Slika 2: Srednje (+ SEM) postprandijalne koncentracije glukoze u plazmi prvog dana Byette Liječenje u bolesnika s dijabetesom tipa 2 liječenih metforminom, sulfonilurejom ili oba (N = 54)
Glukoza na post
U unakrsnoj studiji s jednom dozom u bolesnika s dijabetesom tipa 2 i hiperglikemijom na testu, uslijedilo je trenutno oslobađanje inzulina nakon injekcije Byette. Koncentracije glukoze u plazmi značajno su smanjene kod Byette u usporedbi s placebom (Slika 3).
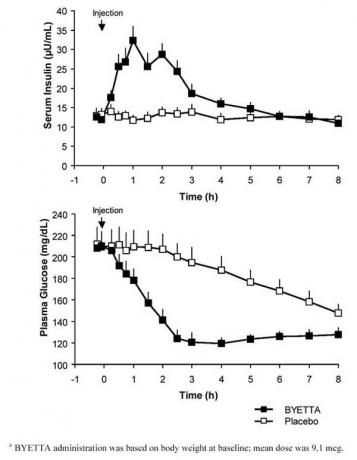
Slika 3: Srednje (+ SEM) koncentracije glukoze u serumu i plazmi nakon jednokratne injekcije Byette ili placebo u bolesnika koji šalju s dijabetesom tipa 2 (N = 12)
vrh
Kliničke studije
Koristite s metforminom i / ili sulfonilurejom
Provedena su tri, dvostruko slijepa, placebo kontrolirana ispitivanja u trajanju od 30 tjedana kako bi se procijenila sigurnost i djelotvornost lijeka Byetta u bolesnika s tipom 2 dijabetesa čija glikemijska kontrola nije bila dovoljna samo za metformin, samu sulfonilureju ili metformin u kombinaciji s sulfonilurejom.
Ukupno je u ova tri ispitivanja bilo nasumično odabrano 1446 bolesnika: 991 (68,5%) je bio kavkaški, 224 (15,5%) je bilo latinoamerički, a 174 (12,0%) je bilo crnaca. Srednje vrijednosti HbA1c u početnim vrijednostima ispitivanja su se kretale u rasponu od 8,2% do 8,7%. Nakon razdoblja uvođenja placeba od 4 tjedna, pacijenti su nasumično dodijeljeni primati Byetta 5 mcg BID, Byetta 10 mcg BID ili placebo BID prije jutarnjih i večernjih obroka, uz postojeće oralne antidijabetike agent. Svi pacijenti dodijeljeni Byetti započeli su razdoblje započinjanja liječenja s 5 mcg BID-a tijekom 4 tjedna. Nakon 4 tjedna, ti su bolesnici ili nastavili primati Byettu od 5 mcg BID ili im se doza povećala na 10 mcg BID. Pacijenti dodijeljeni placebu tijekom cijelog ispitivanja primali su placebo BID.
Primarna krajnja točka svake studije bila je srednja promjena od početne vrijednosti HbA1c u 30 tjedana. Rezultati ispitivanja u trajanju od trideset tjedana sažeti su u tablici 1.
Tablica 1: Rezultati tridesettjednih placebom kontroliranih ispitivanja biette na pacijentima s neadekvatnom kontrolom glukoze unatoč upotrebi metformina, sulfoniluree ili oba
| Placebo PONUDA |
Byetta 5 mcg BID |
Byetta 10 mcg* PONUDA |
|
|---|---|---|---|
| |||
| U kombinaciji s metforminom | |||
| Namjera za liječenje stanovništva (N) | 113 | 110 | 113 |
| HbA1c (%), Srednje | |||
| Osnovna linija | 8.2 | 8.3 | 8.2 |
| Promjena u 30. tjednu | +0.1 | −0.4†| −0.8c |
| Proporcija koja postiže HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Tjelesna težina (kg), srednja | |||
| Osnovna linija | 99.9 | 100.0 | 100.9 |
| Promjena u 30. tjednu | −0.3 | −1.6†| −2.8c |
| U kombinaciji sa sulfonilureom | |||
| Namjera za liječenje stanovništva (N) | 123 | 125 | 129 |
| HbA1c (%), Srednje | |||
| Osnovna linija | 8.7 | 8.5 | 8.6 |
| Promjena u 30. tjednu | +0.1 | −0.5†| −0.9c |
| Proporcija koja postiže HbA1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Tjelesna težina (kg), srednja | |||
| Osnovna linija | 99.1 | 94.9 | 95.2 |
| Promjena u 30. tjednu | −0.6 | −0.9 | −1.6†|
| U kombinaciji s metforminom i sulfonilurejom | |||
| Namjera za liječenje stanovništva (N) | 247 | 245 | 241 |
| HbA1c (%), Srednje | |||
| Osnovna linija | 8.5 | 8.5 | 8.5 |
| Promjena u 30. tjednu | +0.2 | −0.6c | −0.8c |
| Proporcija koja postiže HbA1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Tjelesna težina (kg), srednja | |||
| Osnovna linija | 99.1 | 96.9 | 98.4 |
| Promjena u 30. tjednu | −0.9 | −1.6†| −1.6†|
HbA1c
Dodavanje Byette režimu metformina, sulfoniluree ili oboje, rezultiralo je statistički značajnim smanjenjima od početne vrijednosti HbA1c u 30. tjednu u usporedbi s pacijentima koji su primali placebo dodan ovim sredstvima u tri kontrolirana ispitivanja (stol 1). Pored toga, opažen je statistički značajan učinak doze između 5-mcg i 10-mcg Byetta skupine radi promjene od početne vrijednosti HbA1c u 30. tjednu u tri studije.
Posna i postprandialna glukoza
Dugotrajna upotreba Byette u kombinaciji s metforminom, sulfonilureom ili oboje, smanjila je i post i postprandijalne koncentracije glukoze u plazmi statistički su značajne, ovisno o dozi kroz tjedan 30. Statistički značajno smanjenje vrijednosti od početne vrijednosti i u srednjim i postprandijalnim koncentracijama glukoze uočen je u 30. tjednu u obje skupine Byetta u usporedbi s placebom u podacima kombiniranim iz tri kontrolirane ispitivanja. Promjena koncentracije glukoze na glavi u 30. tjednu u usporedbi s početnom vrijednosti bila je - 8 mg / dL za Byetta od 5 mcg BID i - 10 mg / dl za BIDetu od 10 mcg BID, u usporedbi s +12 mg / dL za placebo. Uspoređivala se promjena u 2-satnoj koncentraciji glukoze nakon prandilizacije nakon primjene Byette u 30. tjednu s početnom vrijednosti bila je 63 mg / dl za 5 mcg BID, a 71 mg / dl za 10 mcg BID, u usporedbi s +11 mg / dL za placebo.
Udio pacijenata koji postižu HbA1c≤7%
Byetta je u kombinaciji s metforminom, sulfonilureom ili oboje rezultirala većim, statistički značajnim udio pacijenata koji su u 30. tjednu postigli HbA1câ -7% u usporedbi s pacijentima koji su primali placebo u kombinaciji s ti agensi (stol 1).
Tjelesna težina
U tri kontrolirana ispitivanja, smanjenje od osnovne tjelesne težine u 30. tjednu povezano je s Byetta 10 mcg BID u usporedbi s placebom BID u bolesnika s dijabetesom tipa 2 (stol 1).
Jednogodišnji klinički rezultati
U skupini od 163 pacijenta iz 30-tjednog placebo kontroliranog ispitivanja koji su završili ukupno 52 tjedna liječenja Byetta 10 mcg BID promjene HbA1c promijenjene su od početne vrijednosti od 1,0% i -1,1% na 30 i 52 tjedna liječenja, prateće promjene od početne vrijednosti glukoze u plazmi natašte od - 14,0 mg / dL i - 25,3 mg / dL, i promjene tjelesne težine - 2,6 kg i - 3,6 kg. Ova kohorta imala je početne vrijednosti slične onima za čitavu populaciju kontroliranog ispitivanja.
Koristite s tiazolidindionom
U randomiziranom, dvostruko slijepom, placebo kontroliranom ispitivanju u trajanju od 16 tjedana, postojećim je dodavan Byetta (n = 121) ili placebo (n = 112) liječenje tiazolidindionom (pioglitazon ili rosiglitazon), sa ili bez metformina, u bolesnika s dijabetesom tipa 2 s neadekvatnim kontrola glikemije. Randomizacija lijeka Byetta ili placebo slojevita je na temelju toga da li su pacijenti primali metformin. Pacijenti dodijeljeni placebu tijekom cijelog ispitivanja primali su placebo BID. Byetta ili placebo ubrizgavali su supkutano prije jutarnjih i večernjih obroka. Sedamdeset i devet posto pacijenata uzimalo je tiazolidindion i metformin, a 21% samo uzimalo je tiazolidindion. Većina bolesnika (84%) bila je bijelci, 8% su bili latinoamerički, a 3% bili su crni. Srednje osnovne vrijednosti HbA1c bile su slične za Byettu i placebo (7,9%). Liječenje Byettom započeto je u dozi od 5 mcg BID tijekom 4 tjedna, a zatim je poraslo na 10 mcg BID još 12 tjedana.
Rezultati šesnaest tjedana sažeti su u tablici 2. U usporedbi s placebom, Byetta je rezultirala statistički značajnim smanjenjem HbA1c od početnog u 16. tjednu. Učinci liječenja za HbA1c bili su slični u dvije podskupine definirane osnovnim slojem liječenja (sami tiazolidindioni u odnosu na tiazolidindione i metformin). Promjena koncentracije glukoze u serumu na glasu od početne do 16. tjedna bila je statistički signifikantna u usporedbi s placebom (21 mg / dl za BIDTA 10 mcg BID u usporedbi s +4 mg / dL za placebo).
Tablica 2: Rezultati 16-tjedna placebo kontroliranog ispitivanja biette u bolesnika s neadekvatnom kontrolom glukoze, unatoč primjeni tiazolidindiona (TZD) ili tiazolidindiona plus metformina
| Placebo PONUDA |
Byetta 10 mcg* PONUDA |
|
|---|---|---|
| ||
| U kombinaciji s TZD ili TZD plus MET | ||
| Namjera za liječenje stanovništva (N) | 112 | 121 |
| HbA1c (%), Srednje | ||
| Osnovna linija | 7.9 | 7.9 |
| Promjena u 16. tjednu | +0.1 | −0.8†|
| Proporcija koja postiže HbA1c≤7%c | 16.2% | 62.3%†|
| Tjelesna težina (kg), srednja | ||
| Osnovna linija | 96.9 | 97.5 |
| Promjena u 16. tjednu | −0.2 | −1.5†|
vrh
Indikacije i upotreba
Byetta je indicirana kao dodatna terapija za poboljšanje kontrole glikemije u bolesnika sa šećernom bolešću tipa 2 koji uzimaju metformin, sulfonilureju i tiazolidindion, kombinacija metformina i sulfoniluree ili kombinacija metformina i tiazolidindiona, ali nisu postigli odgovarajuću glikemiju kontrolirati.
vrh
kontraindikacije
Byetta je kontraindicirana u bolesnika s poznatom preosjetljivošću na exenatid ili neku od komponenti proizvoda.
vrh
Mjere opreza
Općenito
Byetta nije zamjena inzulina za bolesnike koji zahtijevaju inzulin. Byetta se ne smije koristiti u bolesnika s dijabetesom tipa 1 niti za liječenje dijabetičke ketoacidoze.
Pacijenti mogu razviti antieksenatidna antitijela nakon liječenja Byettom, u skladu s potencijalno imunogenim svojstvima proteinskih i peptidnih lijekova. Bolesnike koji primaju Byettu treba promatrati zbog znakova i simptoma reakcija preosjetljivosti.
U malom postotku bolesnika, stvaranje antieksenatidnih antitijela na visokim titrima moglo bi rezultirati neuspjehom postizanja odgovarajućeg poboljšanja kontrole glikemije. Ako postoji pogoršanje glikemijske kontrole ili neuspjeh u postizanju ciljane glikemijske kontrole, treba razmotriti alternativnu antidijabetičku terapiju.
Istodobna primjena Byette s inzulinom, D-fenilalanin derivatima, meglitinidima ili inhibitorima alfa-glukozidaze nije proučavana.
Byetta se ne preporučuje za uporabu u bolesnika s krajnjim stadijem bubrega ili teškim oštećenjem bubrega (klirens kreatinina Farmakokinetika, posebne populacije). U bolesnika s krajnjim stadijem bubrežne bolesti koji su primali dijalizu, pojedinačne doze Byetta 5 mcg nisu se dobro podnosile zbog gastrointestinalnih nuspojava.
Bilo je rijetkih, spontano prijavljenih događaja izmijenjene bubrežne funkcije, uključujući povećani serum kreatinin, oštećenje bubrega, pogoršalo kronično zatajenje bubrega i akutno zatajenje bubrega, ponekad zahtijevajući hemodijaliza. Neki od ovih događaja dogodili su se kod pacijenata koji su primali jedno ili više farmakoloških sredstava za koja se zna da utječu na bubreg funkcija / hidratacijski status i / ili u bolesnika koji imaju mučninu, povraćanje i / ili proljev, sa ili bez dehidracija. Popratna sredstva uključuju inhibitore enzima koji pretvaraju angiotenzin, nesteroidne protuupalne lijekove i diuretike. Zamijećena je reverzibilnost izmijenjene bubrežne funkcije uz potporno liječenje i prekid mogućih uzročnika, uključujući exenatide. U pretkliničkim ili kliničkim ispitivanjima nije nađeno da je egzanid izravno nefrotoksičan.
Byetta nije proučavana u bolesnika s teškom gastrointestinalnom bolešću, uključujući gastroparezu. Njegova je upotreba uobičajeno povezana s gastrointestinalnim štetnim učincima, uključujući mučninu, povraćanje i proljev. Stoga se primjena lijeka Byetta ne preporučuje u bolesnika s teškom gastrointestinalnom bolešću. Treba razmotriti razvoj jake trbušne boli kod pacijenta liječenog Byettom jer to može biti znak upozorenja za ozbiljno stanje.
Hipoglikemija
U 30-tjednom kontroliranom kliničkom ispitivanju s Byettom zabilježena je epizoda hipoglikemije kao štetni događaj ako pacijent je izvijestio o simptomima povezanim s hipoglikemijom uz popratnu glukozu u krvi DOZA I UPRAVA).
Tablica 3: Incidencija (%) hipoglikemije * istodobnom antidijabetičkom terapijom
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Placebo PONUDA |
5 mcg PONUDA |
10 mcg PONUDA |
Placebo PONUDA |
5 mcg PONUDA |
10 mcg PONUDA |
Placebo PONUDA |
5 mcg PONUDA |
10 mcg PONUDA |
|
| S Metforminom | S sulfonilurejom | Sa MET / SFU | |||||||
| Byetta i placebo primijenjeni su prije jutarnjih i večernjih obroka. | |||||||||
| Skraćenice: BID, dva puta dnevno; MET / SFU, metformin i sulfonilurea. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Hipoglikemija | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Kada se koristi kao dodatak tiazolidindionu, sa ili bez metformina, učestalost simptomatske blage do umjerene hipoglikemije kod Byette iznosila je 11% u usporedbi sa 7% kod placeba.
Byetta nije izmijenila proturegulacijske hormonske odgovore na hipoglikemiju uzrokovanu inzulinom u randomiziranom, dvostruko slijepom, kontroliranom ispitivanju na zdravim ispitanicima.
Informacije za pacijente
Bolesnike treba obavijestiti o potencijalnim rizicima Byette. Pacijente bi također trebalo u potpunosti informirati o praksama samoupravljanja, uključujući važnost pravilnog skladištenja Byetta, injekcija tehnika, vrijeme doziranja Byette kao i popratnih oralnih lijekova, pridržavanje planiranja obroka, redovita tjelesna aktivnost, periodično praćenje glukoze u krvi i testiranje na HbA1c, prepoznavanje i liječenje hipoglikemije i hiperglikemije te procjena dijabetesa komplikacije.
Pacijente treba savjetovati da obavijeste liječnika ako su trudni ili namjeravaju zatrudnjeti.
Svaku dozu lijeka Byetta treba primijeniti kao SC injekciju u bedro, abdomen ili nadlakticu u bilo koje vrijeme unutar 60-minutno razdoblje prije jutarnjih i večernjih obroka (ili prije dva glavna obroka u danu, otprilike 6 sati ili više osim). Byetta se ne smije davati nakon obroka. Ako se propusti doza, režim liječenja treba nastaviti kako je propisano sa sljedećom planiranom dozom.
Rizik od hipoglikemije povećava se kada se Byetta koristi u kombinaciji s sredstvom koje inducira hipoglikemiju, poput sulfonilureje. Simptomi, liječenje i stanja koja predisponiraju razvoj hipoglikemije treba objasniti bolesniku. Iako uobičajene upute za liječenje hipoglikemije pacijenta ne moraju biti mijenjane, takve upute trebaju biti preispitao i ojačao tijekom započinjanja Byetta terapije, posebno ako se istodobno primjenjuje sulfonilurea (vidjeti MJERE OPREZA, Hipoglikemija).
Pacijente treba savjetovati da liječenje lijekom Byetta može rezultirati smanjenjem apetita, hrane unosa i / ili tjelesne težine i da zbog toga nema potrebe mijenjati režim doziranja učinke. Liječenje Byettom također može rezultirati mučninom, posebno nakon početka terapije (vidjeti NEPOVOLJNE REAKCIJE).
Pacijent treba pročitati uložak "Informacije za pacijenta" i Korisnički priručnik olovke prije nego što započne Byetta terapiju i pregledati ih svaki put kada se recept dopuni. Pacijenta treba uputiti o pravilnoj uporabi i pohrani olovke, naglašavajući kako i kada postaviti novu olovku, te napomenuvši da je pri početnoj uporabi potreban samo jedan korak postavljanja. Pacijenta treba savjetovati da ne dijeli olovku i igle.
Pacijente treba obavijestiti da igle za olovku nisu isporučene s olovkom i moraju ih kupiti odvojeno. Bolesnike treba savjetovati koje duljine i igle trebaju koristiti.
Interakcije s lijekovima
Učinak Byette na usporeno pražnjenje želuca može smanjiti opseg i brzinu apsorpcije oralno primijenjenih lijekova. Byetta treba primjenjivati s oprezom u bolesnika koji primaju oralne lijekove koji zahtijevaju brzu probavnu apsorpciju. Za oralne lijekove koji su ovisni o pragovnim koncentracijama učinkovitosti, kao što su kontraceptiva i antibiotika, bolesnike treba savjetovati da uzimaju te lijekove najmanje 1 sat prije Injekcija Byette. Ako se takvi lijekovi trebaju davati s hranom, bolesnike treba savjetovati da ih uzimaju uz obrok ili međuobrok kad se ne primjenjuje Byetta. Učinak Byetta na apsorpciju i učinkovitost oralnih kontraceptiva nije karakteriziran.
varfarin
U kontroliranoj kliničkoj farmakološkoj studiji kod zdravih dobrovoljaca uočeno je kašnjenje varfarina Tmax od oko 2 sata kada je varfarin primijenjen 30 minuta nakon Byette. Nisu primijećeni klinički značajni učinci na Cmax ili AUC. No, od uvođenja na tržište, zabilježeni su spontano prijavljeni slučajevi povećanog INR-a (Međunarodni normalizirani omjer) uz istodobnu upotrebu varfarina i Byette, ponekad povezano s krvarenje.
Kancerogeneza, mutageneza, oštećenje plodnosti
Provedeno je 104-tjedno istraživanje kancerogenosti kod mužjaka i ženki štakora u dozama od 18, 70 ili 250 mcg / kg / dan dano bolusnom SC injekcijom. Benigni C-stanični adenomi štitnjače primijećeni su u ženki štakora pri svim dozama exenatida. Incidencija ženki štakora bila je 8% i 5% u dvije kontrolne skupine i 14%, 11%, i 23% u skupinama sa niskom, srednjom i visokom dozom sa sustavnom izloženošću 5, 22 i 130 puta, odnosno, izloženost čovjeku koja je rezultirala iz maksimalne preporučene doze od 20 mcg / dan, u odnosu na površinu plazme ispod krivulje (AUC).
U ispitivanju karcinogenosti u 104 tjedna na miševima u dozama od 18, 70 ili 250 mcg / kg / dan primjenjenim bolusnom SC injekcijom, nisu zabilježeni dokazi o tumorima u dozi do 250 mcg / kg / dan, sistemska izloženost do 95 puta veća od izloženosti ljudi koja je rezultat maksimalne preporučene doze od 20 mcg / dan, temeljeno na AUC.
Exenatid nije bio mutagen ili klastogen, sa ili bez metaboličke aktivacije, u ispitivanju Ames bakterijske mutagenosti ili kromosomske aberacije u stanicama jajnika kineskog hrčka. Exenatid je bio negativan u testu in vivo na mikronukleusu miša.
U studijama plodnosti miša s dozama SC od 6, 68 ili 760 mcg / kg / dan, muškarci su tretirani 4 tjedna prije do parenja i tijekom parenja ženke su tretirane 2 tjedna prije i tijekom parenja do dana trudnoće 7. Nije opažen štetni učinak na plodnost pri 760 mcg / kg / dan, sistemska izloženost 390 puta veća od izloženosti ljudi koja je rezultirala iz maksimalne preporučene doze od 20 mcg / dan, na temelju AUC.
Trudnoća
Trudnoća Kategorija C
Pokazano je da Exenatide uzrokuje smanjeni fetalni i neonatalni rast i kostne učinke kod miševa kod sistemska izloženost 3 puta veća od izloženosti ljudi koja je rezultat maksimalne preporučene doze od 20 mcg / dan, na temelju AUC-a. Pokazano je da Exenatide uzrokuje skeletne učinke kod kunića pri sistemskoj izloženosti 12 puta većoj od izloženosti ljudi koja je rezultat maksimalne preporučene doze od 20 mcg / dan, temeljene na AUC. Ne postoje odgovarajuća i dobro kontrolirana ispitivanja na trudnicama. Byetta se treba koristiti tijekom trudnoće samo ako potencijalna korist opravdava potencijalni rizik za plod.
U ženki miševa kojima su SC doze od 6, 68 ili 760 mcg / kg / dan počele 2 tjedna prije i tijekom parenja do dana gestacije 7, nije bilo štetnih ploda učinci u dozama do 760 mcg / kg / dan, sistemska izloženost do 390 puta veća od izloženosti ljudi koja je rezultat maksimalne preporučene doze od 20 mcg / dan, temeljeno na AUC.
U trudničkih miševa kojima su dane SC doze od 6, 68, 460 ili 760 mcg / kg / dan od dana gestacije 6 do 15 (organogeneza), rascjep nepca (neki s rupama) i nepravilni kostur uočeno je okoštavanje rebra i kostiju lubanje pri 6 mcg / kg / dan, sistemska izloženost 3 puta veća od izloženosti ljudi koja je rezultirala iz maksimalne preporučene doze od 20 mcg / kg / dan, na temelju AUC-a.
U trudnih zečeva kojima su SC doze 0,2, 2, 22, 156, ili 260 mcg / kg / dan od dana gestacije 6 do 18 (organogeneza), nepravilni skelet osifikacije su primijećene pri 2 mcg / kg / dan, sistemska izloženost 12 puta veća od izloženosti ljudi koja je rezultat maksimalne preporučene doze od 20 mcg / dan, na temelju AUC-a.
U trudničkih miševa kojima su SC doze 6, 68 ili 760 mcg / kg / dan od dana gestacije 6 do dana 20 dojenja (odvikavanje) opažen je povećan broj smrti novorođenčadi u danima nakon porođaja 2-4 u branama kojima je dano 6 mcg / kg / dan, sistemska izloženost 3 puta veća od izloženosti ljudi koja je rezultirala iz maksimalne preporučene doze od 20 mcg / dan, na temelju AUC.
Negovateljice
Nije poznato izlučuje li se eksenatid u majčino mlijeko. Mnogi se lijekovi izlučuju u majčino mlijeko i zbog potencijala za klinički značajne štetne reakcije u dojenčadi od exenatide, odluka trebalo bi odlučiti da li će prekinuti proizvodnju mlijeka za konzumaciju ili prekinuti lijek, uzimajući u obzir važnost lijeka za dojenje žena. Ispitivanja laktacijskih miševa pokazala su da je eksenatid prisutan u niskim koncentracijama u mlijeku (manjim ili jednakim 2,5% koncentracije u majčinoj plazmi nakon potkožnog doziranja). Oprez treba biti oprezan kada se Byetta daje nekoj ženi.
Dječja upotreba
Sigurnost i djelotvornost lijeka Byetta nisu utvrđene u pedijatrijskih bolesnika.
Gerijatrijska upotreba
Byetta je proučavana u 282 bolesnika starijih od 65 godina i u 16 bolesnika starijih od 75 godina. Nisu primijećene razlike u sigurnosti ili učinkovitosti između ovih i mlađih bolesnika.
vrh
Nuspojave
Koristite s metforminom i / ili sulfonilurejom
U tri kontrolirana ispitivanja dodatka Byetta metforminu i / ili sulfonilureji u trajanju od 30 tjedana, štetni događaji s incidencijom ‰% 5% (isključujući hipoglikemiju; vidjeti Tablica 3) koji su se češće javljali kod pacijenata liječenih Byettom u usporedbi s bolesnicima koji su primali placebo sažeti su u tablici 4.
Tablica 4: Česti neželjeni događaji u hitnim slučajevima (‰% incidencija i veća incidencija liječenjem Byetta) isključujući hipoglikemiju *
| Placebo BID N = 483 % |
Sva Byetta BID N = 963 % |
|
|---|---|---|
| ||
| Mučnina | 18 | 44 |
| povraćanje | 4 | 13 |
| Proljev | 6 | 13 |
| Osjećaj nervoze | 4 | 9 |
| Vrtoglavica | 6 | 9 |
| Glavobolja | 6 | 9 |
| Dispepsija | 3 | 6 |
Nuspojave povezane s Byettom uglavnom su bile blage do umjerene jačine. Najčešće prijavljeni neželjeni događaj, blaga do umjerena mučnina, dogodio se na način ovisan o dozi. Uz kontinuiranu terapiju, učestalost i ozbiljnost s vremenom su se smanjivali kod većine bolesnika koji su u početku osjećali mučninu. Nuspojave prijavljene u ≥ 1,0 do <5,0% pacijenata koji su primali Byettu i prijavljeni češće nego kod placeba uključuje asteniju (uglavnom prijavljenu kao slabost), smanjeni apetit, gastroezofagealnu refluksnu bolest i hiperhidroza. Pacijenti u produženim ispitivanjima u 52. tjedna imali su slične vrste nuspojava opažene u kontroliranim ispitivanjima u 30-ak tjedana.
Incidencija povlačenja uslijed štetnih događaja bila je 7% za bolesnike liječene Byettom i 3% za bolesnike liječene placebom. Najčešći nuspojave koje su dovele do povlačenja bolesnika liječenih Byettom bile su mučnina (3% bolesnika) i povraćanje (1%). Za bolesnike liječene placebom, <1% se povuklo zbog mučnine i 0% zbog povraćanja.
Koristite s tiazolidindionom
U 16-tjednoj placebo kontroliranoj studiji dodatka Byetta tiazolidindionu, sa ili bez metformina, učestalosti i vrsti ostali opaženi nuspojave bili su slični onima zabilježenim u 30-tjednom kontroliranom kliničkom ispitivanju s metforminom i / ili a sulfonilurejom. Nisu zabilježeni ozbiljni nuspojave u skupini koja je primala placebo. Dva ozbiljna štetna događaja, naime bol u prsima (što dovodi do povlačenja) i kronični preosjetljivi pneumonitis, prijavljena su u ruci Byette.
Učestalost povlačenja uslijed štetnih događaja bila je 16% (19/121) za bolesnike liječene Byettom i 2% (2/112) za bolesnike liječene placebom. Najčešći nuspojave koje su dovele do povlačenja za bolesnike liječene Byettom bile su mučnina (9%) i povraćanje (5%). Za bolesnike liječene placebom, <1% se povuklo zbog mučnine. Prehlada (n = 4) i reakcije na mjestu ubrizgavanja (n = 2) pojavile su se samo u bolesnika liječenih Byettom. Dva pacijenta koji su prijavili reakciju na mjestu ubrizgavanja imali su visok titar anti-exenatid antitijela.
Spontani podaci
Od uvođenja Byette na tržište, zabilježene su sljedeće dodatne nuspojave. Budući da se ti događaji prijavljuju dobrovoljno iz populacije neizvjesne veličine, nije uvijek moguće pouzdano procijeniti njihovu učestalost ili uspostaviti uzročno-posljedičnu vezu s izlaganjem lijekovima.
Općenito: reakcije na mjestu ubrizgavanja; disgeuzija; somnolencije, INR se povećao uz istodobnu upotrebu varfarina (neka izvješća povezana s krvarenjem).
Alergija / preosjetljivost: generalizirani pruritus i / ili urtikarija, makularni ili papularni osip, angioedem; rijetka izvješća o anafilaktičkoj reakciji.
Gastrointestinalni: mučnina, povraćanje i / ili proljev što rezultira dehidracijom; distenzija u trbuhu, bol u trbuhu, erukcija, zatvor, nadimanje, akutni pankreatitis.
Bubrežni i mokraćni poremećaji: izmijenjena bubrežna funkcija, uključujući akutno zatajenje bubrega, pogoršano kronično bubrežno zatajenje, oštećenje bubrega, porast serumskog kreatinina (vidi MJERE OPREZA).
Imunogenost
U skladu s potencijalno imunogenim svojstvima proteinskih i peptidnih lijekova, nakon liječenja Byettom pacijenti mogu razviti antieksenatidna antitijela. U većine bolesnika koji razviju antitijela, titri protutijela smanjuju se s vremenom.
U 30-tjednim kontroliranim ispitivanjima dodatka Byetta metforminu i / ili sulfonilureji, 38% bolesnika imalo je anti-exenatidna antitijela niskog titra u 30 tjedana. Za ovu skupinu, razina kontrole glikemije (HbA1c) općenito je usporediva s onom opaženom u one bez titra antitijela. Dodatnih 6% bolesnika imalo je protutijela s višim titrom u 30. tjednu. U otprilike polovine od ovih 6% (3% ukupnog broja pacijenata koji su dobili Byetta u 30-tjednom kontroliranom ispitivanju), glikemijski odgovor na Byettu je bio umanjen; ostatak je imao glikemijski odgovor usporediv s onim kod pacijenata bez antitijela.
U 16-tjednom ispitivanju dodatka Byetta tiazolidindionima, sa ili bez metformina, 9% bolesnika imalo je protutijela s višim titrom u 16 tjedana. U usporedbi s pacijentima koji nisu razvili antitijela na Byettu, u prosjeku je glikemijski odgovor u bolesnika s antitijelima s višim titrom bio oslabljen.
Treba nadzirati bolesnikov glikemijski odgovor na Byetta. Ako postoji pogoršanje glikemijske kontrole ili neuspjeh u postizanju ciljane glikemijske kontrole, treba razmotriti alternativnu antidijabetičku terapiju.
vrh
predoziranje
U kliničkoj studiji Byetta, troje bolesnika s dijabetesom tipa 2 iskusilo je jedno predoziranje od 100 mcg SC (10 puta veća od maksimalne preporučene doze). Učinci predoziranja uključuju jaku mučninu, jako povraćanje i naglo smanjenje koncentracije glukoze u krvi. Jedan od tri pacijenta iskusio je tešku hipoglikemiju koja je zahtijevala parenteralnu primjenu glukoze. Troje pacijenata oporavljalo se bez komplikacija. U slučaju predoziranja potrebno je započeti odgovarajuće potporno liječenje u skladu s kliničkim znacima i simptomima pacijenta.
vrh
Doziranje i primjena
Terapiju bajeta treba započeti s 5 mcg po dozi koja se daje dva puta dnevno u bilo koje vrijeme unutar 60 minuta period prije jutarnjih i večernjih obroka (ili prije dva glavna obroka u danu, otprilike 6 sati ili više osim). Byetta se ne smije davati nakon obroka. Na temelju kliničkog odgovora, doza lijeka Byetta može se povećati na 10 mcg dva puta dnevno nakon mjesec dana terapije. Svaku dozu treba primijeniti kao SC injekciju u bedro, abdomen ili nadlakticu.
Byetta se preporučuje za uporabu kod bolesnika sa šećernom bolešću tipa 2 koji već primaju metformin, sulfonilureju, a tiazolidindion, kombinacija metformina i sulfoniluree ili kombinacija metformina i tiazolidindiona i imaju suptptimal kontrola glikemije. Kada se Byetta doda u terapiju metforminom ili tiazolidindionom, trenutna doza metformina ili tiazolidindiona može se nastaviti jer je malo vjerojatno da će doza metformina ili tiazolidindiona zahtijevati prilagodbu zbog hipoglikemije ako se koristi s Byettom. Kada se Byetta doda u terapiju sulfonilurejom, može se razmotriti smanjenje doze sulfonilureje za smanjenje rizika od hipoglikemije (vidjeti MJERE OPREZA, Hipoglikemija).
Byetta je bistra i bezbojna tekućina i ne smije se koristiti ako se pojave čestice ili je otopina zamućena ili obojena. Byetta se ne smije upotrijebiti prije isteka roka valjanosti. Nema podataka o sigurnosti i djelotvornosti intravenske ili intramuskularne injekcije Byette.
vrh
skladištenje
Prije prve uporabe, Byetta se mora čuvati u hladnjaku na 2 ° C do 8 ° C. Nakon prve upotrebe, Byetta se može čuvati na temperaturi (25 ° C) koja ne prelazi 77 ° F. Ne smrzavajte se. Ne koristite Byetta ako je bila smrznuta. Byetta treba biti zaštićena od svjetlosti. Olovku treba odbaciti 30 dana nakon prve upotrebe, čak i ako neki lijek ostane u olovci.
vrh
Kako se nabavlja
Byetta se isporučuje kao sterilna otopina za supkutanu injekciju koja sadrži 250 mcg / ml exenatida. Dostupni su sljedeći paketi:
5 mcg po dozi, 60 doza, 1,2 ml napunjena olovka NDC 66780-210-07
10 mcg po dozi, 60 doza, 2,4 ml napunjena olovka NDC 66780-210-08
Rx SAMO
Proizvedeno za Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Markirala Amylin Pharmaceuticals, Inc. i Eli Lilly i kompanija
1-800-868-1190
http://www.Byetta.com
Byetta je registrirani zaštitni znak tvrtke Amylin Pharmaceuticals, Inc.
© 2007. Amylin Pharmaceuticals, Inc. Sva prava pridržana.
zadnji put ažurirano 09/2007
Informacije o pacijentu Byetta (Exenatide) (na običnom engleskom)
Detaljne informacije o znakovima, simptomima, uzrocima, liječenjima dijabetesa
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
natrag na: Pregledajte sve lijekove za dijabetes



