Onglyza za liječenje dijabetesa
Naziv marke: Onglyza
Generičko ime: Saksagliptin
Oblik doziranja: tableta, filmom obložena
Sadržaj:
Indikacije i upotreba
Doziranje i primjena
Oblici i snage doziranja
kontraindikacije
Upozorenja i mjere opreza
Nuspojave
Interakcije s lijekovima
Upotreba u određenoj populaciji
predoziranje
Opis
Farmakologija
Neklinička toksikologija
Kliničke studije
Kako se isporučuje
Podaci o pacijentu Onglyza (na običnom engleskom)
Indikacije i upotreba
Monoterapija i kombinirana terapija
Onglyza je indicirana kao dodatak prehrani i vježbanju radi poboljšanja kontrole glikemije u odraslih s dijabetesom melitusa tipa 2. [Vidjeti Kliničke studije].
Važna ograničenja uporabe
Onglyza se ne smije koristiti za liječenje dijabetesa melitusa tipa 1 ili dijabetičke ketoacidoze, jer u tim sredinama ne bi bio učinkovit.
Onglyza nije ispitivan u kombinaciji s inzulinom.
vrh
Doziranje i primjena
Preporučeno doziranje
Preporučena doza Onglyza je 2,5 mg ili 5 mg jednom dnevno, bez obzira na obroke.
Pacijenti s oštećenjem bubrega
Ne preporučuje se prilagođavanje doze za Onglyza za bolesnike s blagim oštećenjem bubrega (klirens kreatinina [CrCl]> 50 mL / min).
Doza Onglyza je 2,5 mg jednom dnevno za bolesnike s umjerenim ili teškim oštećenjem bubrega, ili s bolesti bubrega u završnom stadiju (ESRD) koja zahtijeva hemodijalizu (klirens kreatinina [CrCl] â ‰ ¤50 ml / min). Onglyza se mora primjenjivati nakon hemodijalize. Onglyza nije ispitivan u bolesnika koji su podvrgnuti peritonealnoj dijalizi.
Budući da doza Onglyza treba biti ograničena na 2,5 mg na temelju bubrežne funkcije, preporučuje se procjena bubrežne funkcije prije započinjanja lijeka Onglyza i periodično nakon toga. Bubrežna funkcija može se procijeniti iz serumskog kreatinina pomoću Cockcroft-Gault formule ili Promjene prehrane u formuli bubrežne bolesti. [Vidjeti Klinička farmakologija, Farmakokinetika.]
Jaki inhibitori CYP3A4 / 5
Doza Onglyza je 2,5 mg jednom dnevno kada se primjenjuje zajedno s jakim inhibitorima citokroma P450 3A4 / 5 (CYP3A4 / 5) (npr. ketokonazol, atazanavir, klaritromicin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, sakvinavir i telitromicin). [Vidjeti Interakcije s lijekovima, Inhibitore enzima CYP3A4 / 5 i Klinička farmakologija, Farmakokinetika.]
vrh
Oblici i snage doziranja
- Onglyza (saksagliptin) 5 mg tablete su ružičaste, bikonveksne, okrugle, filmom obložene tablete s natpisom "5" s jedne strane i "4215" ispisanim na naličju, plavom tintom.
- Onglyza (saksagliptin) 2,5 mg tablete su blijedo žute do svijetlo žute, bikonveksne, okrugle, filmom obložene tablete s natpisom "2,5" s jedne strane i "4214" ispisanim na naličju, plavom tintom.
vrh
kontraindikacije
Niti jedan.
vrh
Upozorenja i mjere opreza
Upotreba s lijekovima za koje je poznato da uzrokuju hipoglikemiju
Sekretagozi inzulina, poput sulfonilureje, uzrokuju hipoglikemiju. Stoga će biti potrebna manja doza sekretagoga za inzulin kako bi se smanjio rizik od hipoglikemije ako se koristi u kombinaciji s Onglyzom. [Vidjeti Nuspojave, Iskustvo kliničkih ispitivanja.]
Makrovaskularni ishodi
Nije bilo kliničkih studija koje bi utvrdile konačne dokaze o smanjenju makrovaskularnog rizika s Onglyzom ili bilo kojim drugim antidijabetičkim lijekom.
vrh
Nuspojave
Iskustvo kliničkih ispitivanja
Budući da se klinička ispitivanja provode u vrlo promjenjivim uvjetima, postotak nuspojava opažen u kliničkim ispitivanjima a lijek se ne može izravno uspoređivati sa stopama kliničkih ispitivanja drugog lijeka i ne mora odražavati stope opažene u praksa.
Monoterapija i dodatna kombinirana terapija
U dva ispitivanja liječenja monoboterapijom u trajanju od 24 tjedna, bolesnici su liječeni 2,5 mg Onglyza dnevno, 5 mg Onglyza dnevno i placebo. Provedena su i tri 24-tjedna, placebo kontrolirana, kombinacijska kombinirana terapija: jedno s metforminom, jedno s tiazolidindionom (pioglitazon ili rosiglitazon) i jedno s gliburidom. U ova tri ispitivanja, pacijenti su nasumično odabrani na dodatnu terapiju s 2,5 mg dnevno Onglyza, 5 mg dnevno Onglyza ili placebom. Ruka za liječenje saksagliptinom od 10 mg uključena je u jedno ispitivanje monoterapije i u ispitivanju dodataka u kombinaciji s metforminom.
U unaprijed specificiranoj analizi podataka u trajanju od 24 tjedna (bez obzira na spašavanje glikemije) iz dva ispitivanja s monoterapijom, dodatkom ispitivanju metformina, dodatku ispitivanju tiazolidindiona (TZD), i dodatka ispitivanju gliburida, ukupna učestalost nuspojava u bolesnika liječenih 2,5 mg Onglyza i Onglyza 5 mg bila je slična placebu (72,0% i 72,2% nasuprot 70,6%, odnosno). Prekid terapije uslijed štetnih događaja dogodio se u 2,2%, 3,3%, odnosno 1,8% bolesnika koji su primali Onglyza 2,5 mg, Onglyza 5 mg i placebo. Najčešći neželjeni događaji (prijavljeni kod najmanje 2 pacijenta liječenih 2,5 mg Onglyza ili najmanje 2 bolesnika liječenih Onglyzom 5 mg) povezano s preuranjenim prekidom liječenja uključivalo je limfopeniju (0,1% i 0,5% prema 0%, respektivno), osip (0,2% i 0,3% u odnosu na 0,3%) povećao se kreatinin u krvi (0,3% i 0% u odnosu na 0%), a kreatin fosfokinaza u krvi povećao se (0,1% i 0,2% u odnosu na 0%). Nuspojave u ovoj združenoj analizi prijavljene su (neovisno o procjeni uzročnosti od strane istraživača) u ‰ ¥ 5% bolesnika liječenih Onglyzom 5 mg, a češće nego kod bolesnika liječenih placebom prikazano je u Stol 1.
Tablica 1: Neželjene reakcije (bez obzira na istražiteljevu procjenu uzročnosti) u pokusima kontroliranim placebom * Prijavljeno u 5% bolesnika liječenih Onglyzom od 5 mg i češće nego u bolesnika liječenih Placebo
| Broj (%) bolesnika | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * 5 ispitivanja koja su kontrolirana placebom uključuju dva ispitivanja monoterapije i jedno ispitivanje s dodatnom kombiniranom terapijom sa svakim od sljedećeg: metformin, tiazolidindion ili gliburid. Tablica prikazuje podatke od 24 tjedna bez obzira na spašavanje glikemije. | ||
| Infekcija gornjih dišnih puteva | 68 (7.7) | 61 (7.6) |
| Infekcija mokraćnih puteva | 60 (6.8) | 49 (6.1) |
| Glavobolja | 57 (6.5) | 47 (5.9) |
U bolesnika liječenih 2,5 mg Onglyza, glavobolja (6,5%) bila je jedina nuspojava prijavljena brzinom 5% i češća nego u bolesnika liječenih placebom.
U ovu skupnu analizu, nuspojave o kojima su zabilježene u ¥% 2% bolesnika liječenih Onglyza 2,5 mg ili Onglyza 5 mg i ¥ ¥% češće u usporedbi s placebom: sinusitis (2,9% i 2,6% u odnosu na 1,6%, respektivno), bol u trbuhu (2,4% i 1,7% u odnosu na 0,5%), gastroenteritis (1,9% i 2,3% u odnosu na 0,9%) i povraćanje (2,2% i 2,3% u odnosu na 1,3%) ).
U dodatku ispitivanju TZD-a, učestalost perifernih edema bila je veća za Onglyza od 5 mg u odnosu na placebo (8,1%, odnosno 4,3%). Incidencija perifernih edema za 2,5 mg Onglyza iznosila je 3,1%. Niti jedna prijavljena nuspojava perifernog edema nije rezultirala prekidom liječenja ispitivanim lijekom. Stope perifernog edema za Onglyza 2,5 mg i Onglyza 5 mg naspram placeba bile su 3,6% i 2% nasuprot 3% dane kao monoterapija, 2,1% i 2,1% nasuprot 2,2% danih kao dodatna terapija metforminom, i 2,4% i 1,2% nasuprot 2,2% danih kao dodatna terapija za gliburid.
Stopa incidencije prijeloma bila je 1,0 i 0,6 na 100 bolesničkih godina, za Onglyza (združena analiza 2,5 mg, 5 mg i 10 mg) i placebo. Stopa incidencije prijeloma kod pacijenata koji su primali Onglyzu s vremenom se nije povećavala. Uzročnost nije utvrđena, a neklinička ispitivanja nisu dokazala štetne učinke saksagliptina na kosti.
U kliničkom programu uočen je događaj trombocitopenije, u skladu s dijagnozom idiopatske trombocitopenične purpure. Odnos ovog događaja prema Onglyzi nije poznat.
Nuspojave povezane s lijekom Onglyza koji se primjenjuje zajedno s metforminom u naivnih bolesnika s dijabetesom tipa 2
Tablica 2 prikazuje nuspojave prijavljene (bez obzira na procjenu uzročnika) kod 5% bolesnika sudjelovanje u dodatnom 24-tjednom, aktivnom kontroliranom pokusu istodobno uzimanog lijeka Onglyza i metformina u liječenju naivnom pacijenata.
Tablica 2: Početna terapija kombinacijom onglyze i metformina u bolesnika koji nisu na liječenju: prijavljeni su nuspojave (bez obzira na procjenu istražitelja kauzalnosti) kod 5% bolesnika liječenih kombiniranom terapijom Onglyza 5 mg plus metforminom (i češće nego u bolesnika liječenih metforminom Sam)
| Broj (%) bolesnika | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
metformin * N = 328 |
|
| * Metformin je započet u početnoj dozi od 500 mg dnevno i titriran do maksimalno 2000 mg dnevno. | ||
| Glavobolja | 24 (7.5) | 17 (5.2) |
| Nasopharyngitis | 22 (6.9) | 13 (4.0) |
Hipoglikemija
Nuspojave hipoglikemije temeljile su se na svim izvještajima o hipoglikemiji; istodobno mjerenje glukoze nije potrebno. U dodatku ispitivanju gliburida, ukupna učestalost prijavljene hipoglikemije bila je veća za 2,5 mg Onglyza i 5 mg (13,3% i 14,6%) Onglyza u odnosu na placebo (10,1%). Učestalost potvrđene hipoglikemije u ovom istraživanju, definirana kao simptomi hipoglikemije u pratnji a vrijednost glukoze u prstima od ¤ mg50 mg / dL, bila je 2,4% i 0,8% za Onglyza 2,5 mg i Onglyza 5 mg i 0,7% za placebo. Incidencija prijavljene hipoglikemije za 2,5 mg Onglyza i 5 mg Onglyza u odnosu na placebo kao monoterapiju iznosila je 4,0% i 5,6% 4,1%, odnosno 7,8% i 5,8% nasuprot 5% danih kao dodatna terapija metforminom, i 4,1% i 2,7% u odnosu na 3,8% danih kao dodatna terapija za TZD. Incidencija prijavljene hipoglikemije bila je 3,4% kod naivno liječenih bolesnika koji su uzimali Onglyza 5 mg plus metformin i 4,0% u bolesnika koji su davali samo metformin.
Reakcije preosjetljivosti
Događaji povezani s preosjetljivošću, kao što su urtikarija i edemi lica u petom istraživanju sakupljenom u petom istraživanju do 24. tjedna prijavljeni su u 1,5%, 1,5% i 0,4% bolesnika koji su primali Onglyza 2,5 mg, Onglyza 5 mg i placebo, odnosno. Niti jedan od ovih događaja kod pacijenata koji su primali Onglyzu nije zahtijevao hospitalizaciju ili su istražitelji navodili kao opasne po život. Jedan pacijent liječen saksagliptinom u ovoj združenoj analizi prekinut je zbog generalizirane urtikarije i edema lica.
Vitalni znakovi
Nisu primijećene klinički značajne promjene vitalnih znakova u bolesnika liječenih Onglyzom.
Laboratorijska ispitivanja
Apsolutni brojevi limfocita
Zabilježeno je prosječno smanjenje ovisnosti o apsolutnoj količini limfocita povezano s dozom s lijekom Onglyza. Srednja vrijednost apsolutnog broja limfocita od približno 2200 stanica / mikroL, prosječno smanjenje od oko 100 i 120 stanica / mikroL s U zbirnoj analizi pet kliničkih lijekova kontroliranih placebom, tijekom 24 tjedna opaženi su Onglyza 5 mg i 10 mg, u odnosu na placebo studije. Slični učinci primijećeni su kada je Onglyza 5 mg dan u početnoj kombinaciji s metforminom u usporedbi s metforminom. Nije uočena razlika za 2,5 mg Onglyza u odnosu na placebo. Udio bolesnika za koje je prijavljeno da su broj limfocita ¤ 50750 stanica / mikroL iznosio je 0,5%, 1,5%, 1,4% i 0,4% u saksagliptinu, 2,5 mg, 5 mg, 10 mg, i placebo skupini. Kod većine bolesnika recidivi nisu zabilježeni uz opetovano izlaganje Onglyzi, mada su neki pacijenti imali ponavljajuće smanjenje nakon ponovnog izazivanja što je dovelo do prekida liječenja Onglyzom. Smanjenje broja limfocita nije bilo povezano s klinički relevantnim nuspojavama.
Klinički značaj ovog smanjenja broja limfocita u odnosu na placebo nije poznat. Kad je klinički indicirano, kao što je u uvjetima neobične ili dugotrajne infekcije, potrebno je izmjeriti broj limfocita. Učinak Onglyza na broj limfocita u bolesnika s poremećajima limfocita (npr. Virusom humane imunodeficijencije) nije poznat.
trombociti
U šest, dvostruko slijepih, kontroliranih kliničkih ispitivanja sigurnosti i učinkovitosti, Onglyza nije pokazao klinički značajan ili konzistentan učinak na broj trombocita.
vrh
Interakcije s lijekovima
Induktori enzima CYP3A4 / 5
Rifampin je značajno smanjio izloženost saksagliptinu, bez promjene područja ispod krivulje koncentracije vremena (AUC) njegovog aktivnog metabolita, 5-hidroksi saksagliptina. Na inhibiciju aktivnosti dipeptidil peptidaze-4 u plazmi tijekom intervala doze od 24 sata nije utjecao rifampin. Stoga se ne preporučuje prilagođavanje doze Onglyza. [Vidjeti Klinička farmakologija, Farmakokinetika.]
Inhibitori enzima CYP3A4 / 5
Umjereni inhibitori CYP3A4 / 5
Diltiazem je povećao izloženost saksagliptinu. Slično povećanje plazemskih koncentracija saksagliptina predviđa se u prisutnosti drugih umjerenih CYP3A4 / 5 inhibitore (npr. amprenavir, aprepitant, eritromicin, flukonazol, fosamprenavir, sok od grejpa i verapamil); međutim, ne preporučuje se prilagođavanje doze Onglyze. [Vidjeti Klinička farmakologija, Farmakokinetika.]
Jaki inhibitori CYP3A4 / 5
Ketokonazol je značajno povećao izloženost saksagliptinu. Očekuje se slična značajna povećanja koncentracije saksagliptina u plazmi s drugim jakim inhibitorima CYP3A4 / 5 (npr. atazanavir, klaritromicin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, sakvinavir i telitromicin). Doza Onglyza treba biti ograničena na 2,5 mg kada se istodobno primjenjuje s jakim inhibitorom CYP3A4 / 5. [Vidjeti Doziranje i primjena, Jaki inhibitori CYP3A4 / 5 i Klinička farmakologija, Farmakokinetika.]
vrh
Upotreba u određenoj populaciji
Trudnoća
Trudnoća kategorija B
Ne postoje odgovarajuća i dobro kontrolirana ispitivanja na trudnicama. Budući da studije reprodukcije životinja ne predviđaju uvijek ljudski odgovor, Onglyza se, kao i drugi antidijabetički lijekovi, treba koristiti tijekom trudnoće samo ako je to očigledno potrebno.
Saksagliptin nije bio teratogen u bilo kojoj dozi ispitanoj tijekom davanja trudnicama štakorima i zečevima tijekom razdoblja organogeneze. Nepotpuna okoštavanje zdjelice, oblik zastoja u razvoju, dogodila se kod štakora u dozi od 240 mg / kg, odnosno približno 1503 i 66 puta veća izloženost ljudi saksagliptinu i aktivnom metabolitu, pri najvećoj preporučenoj ljudskoj dozi (MRHD) od 5 mg. Zabilježena je toksičnost za majku i smanjena tjelesna težina 7986 i 328 puta veća od izloženosti ljudi na MRHD-u saksagliptinu, odnosno aktivnom metabolitu. Male koštane varijacije kod kunića pojavljuju se u majčinski toksičnoj dozi od 200 mg / kg, odnosno približno 1432 i 992 puta više od MRHD-a. Kad se daje štakorima u kombinaciji s metforminom, saksagliptin nije bio teratogen niti embrioletalan pri izloženosti 21 puta većoj od MRHD saksagliptina. Kombinirano davanje metformina s većom dozom saksagliptina (109 puta više od saksagliptina MRHD) povezano je s kraniorachischisis (rijetka oštećenja neuralne cijevi karakterizirana nepotpunim zatvaranjem lubanje i kralježnice) u dva ploda iz jedna brana. Izlaganja metforminu u svakoj kombinaciji bila su 4 puta veća od izloženosti ljudi od 2000 mg dnevno.
Saksagliptin primijenjen na ženke štakora od dana gestacije do dana 20 dojenja rezultirao je smanjenim tjelesnim težinama kod mužjaka i žensko potomstvo samo u majčinski toksičnim dozama (izloženost 1629 i 53 puta saksagliptin i njegov aktivni metabolit u MRHD). Nije opažena funkcionalna ili bihevioralna toksičnost kod potomstva štakora kojima su davani saksagliptin u bilo kojoj dozi.
Saksagliptin prelazi placentu u fetus nakon doziranja u trudničke štakore.
Negovateljice
Saksagliptin se izlučuje u mlijeku štakora koje doje u približno 1: 1 omjeru s koncentracijama lijeka u plazmi. Nije poznato da li se saksagliptin izlučuje u majčinom mlijeku. Budući da se mnogi lijekovi izlučuju u ljudskom mlijeku, treba biti oprezan kada se Onglyza primjenjuje dojiljama.
Dječja upotreba
Sigurnost i djelotvornost Onglyza kod pedijatrijskih bolesnika nisu utvrđene.
Gerijatrijska upotreba
U šest, dvostruko slijepih, kontroliranih ispitivanja kliničke sigurnosti i učinkovitosti Onglyza, 634 (15,3%) od 4148 nasumičnih bolesnika bilo je 65 i više godina, a 59 (1,4%) bolesnika u dobi od 75 i više godina. Nisu primijećene ukupne razlike u sigurnosti ili učinkovitosti između pacijenata starijih od 65 godina i mlađih pacijenata. Iako ovo kliničko iskustvo nije utvrdilo razlike u odgovorima između starijih i mlađih pacijenata, ne može se isključiti veća osjetljivost nekih starijih osoba.
Saksagliptin i njegov aktivni metabolit dijelom uklanjaju bubreg. Budući da je u starijih bolesnika vjerojatnost smanjene funkcije bubrega potrebno paziti na odabir doze kod starijih osoba na temelju bubrežne funkcije. [Vidjeti Doziranje i primjena, Bolesnici s oštećenjem bubrega i Klinička farmakologija, Farmakokinetika.]
vrh
predoziranje
U kontroliranom kliničkom ispitivanju, jedanput dnevno, oralno primijenjeno Onglyza kod zdravih ispitanika u dozama do 400 mg dnevno tijekom 2 tjedna (80 puta MRHD) nije imao kliničke nuspojave povezane s dozom i nije imao klinički značajan učinak na QTc interval ili srce stopa.
U slučaju predoziranja potrebno je započeti odgovarajuće suportivno liječenje kako to diktira klinički status pacijenta. Saksagliptin i njegov aktivni metabolit uklanjaju se hemodijalizom (23% doze tijekom 4 sata).
vrh
Opis
Saksagliptin je oralno aktivni inhibitor enzima DPP4.
Saksagliptin monohidrat se kemijski opisuje kao (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hidroksitriklo) [3.3.1.13,7] dec-1-il) acetil] -2-azabiciklo [3.1.0] heksan-3-karbonitril, monohidrat ili (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hidroksiadamantan - 1 - il) acetil] - 2 - azabiciklo [3.1.0] heksan - 3 - karbonitril hidrat. Empirijska formula je C18H25N3O2H20 i molekulska masa je 333,43. Strukturna formula je:
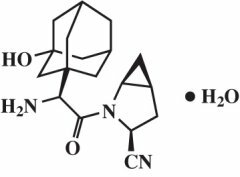
Saksagliptin monohidrat je bijelo do svijetložuti ili svijetlosmeđi, nehigroskopski, kristalni prah. Vrlo je topiv u vodi pri 24 ° C ± 3 ° C, slabo topljiv u etil acetatu i topiv u metanolu, etanolu, izopropil alkoholu, acetonitrilu, acetonu i polietilen glikolu 400 (PEG 400).
Svaka filmom obložena tableta Onglyza za oralnu upotrebu sadrži 2,79 mg saksagliptin hidroklorida (bezvodnog) ekvivalent 2,5 mg saksagliptina ili 5,58 mg saksagliptina hidroklorid (bezvodni) ekvivalent 5 mg saksagliptina i slijedeći neaktivni sastojci: laktoza monohidrat, mikrokristalna celuloza, natrij kroskarmeloza i magnezijev stearat. Pored toga, filmski premaz sadrži sljedeće neaktivne sastojke: polivinil alkohol, polietilen glikol, titanov dioksid, talk i željezove okside.
vrh
Klinička farmakologija
Mehanizam djelovanja
Povećana koncentracija inkretinskih hormona, poput peptida sličnog glukagonu-1 (GLP-1) i ovisnog o glukozi inzulinotropni polipeptid (GIP) oslobađa se u krvotok iz tankog crijeva kao odgovor na obroka. Ovi hormoni uzrokuju otpuštanje inzulina iz beta stanica gušterače na način ovisan o glukozi, ali inaktiviraju se enzimom dipeptidil peptidaza-4 (DPP4) u roku od nekoliko minuta. GLP-1 također smanjuje lučenje glukagona iz alfa-stanica gušterače, smanjujući stvaranje glukoze u jetri. U bolesnika s dijabetesom tipa 2, koncentracije GLP-1 su smanjene, ali odgovor inzulina na GLP-1 je sačuvan. Saksagliptin je konkurentni inhibitor DPP4 koji usporava inaktivaciju hormona inkretina i na taj način povećava njihov krvotok koncentracije i smanjenje koncentracije glukoze na tešče i postprandijalno na način ovisan o glukozi u bolesnika s dijabetesom tipa 2 bolest.
farmakodinamiku
U bolesnika sa šećernom bolešću tipa 2, primjena Onglyza inhibira aktivnost enzima DPP4 tijekom razdoblja od 24 sata. Nakon oralnog opterećenja glukozom ili obroka, ova inhibicija DPP4 rezultirala je 2- do 3-kratnim povećanjem nivoa cirkulacije u krvi GLP-1 i GIP, smanjene koncentracije glukagona i povećane lučenja ovisnih o glukozi iz beta stanica gušterače. Porast inzulina i smanjenje glukagona bili su povezani s nižim koncentracijama glukoze na glasu i smanjenim izletom glukoze nakon oralnog opterećenja glukozom ili obroka.
Srčana elektrofiziologija
U randomiziranom, dvostruko slijepom, placebo kontroliranom, četverosmjernom crossover, aktivnom komparacijskom istraživanju korištenjem moksifloksacina na 40 zdravih ispitanika, Onglyza nije bila povezana s klinički značajnim produženjem QTc intervala ili brzine otkucaja srca u dnevnim dozama do 40 mg (8 puta više od MRHD).
farmakokinetika
Farmakokinetika saksagliptina i njegovog aktivnog metabolita, 5-hidroksi saksagliptina bila je slična u zdravih ispitanika i u bolesnika sa šećernom bolešću tipa 2. Cmaksimum i AUC vrijednosti saksagliptina i njegovog aktivnog metabolita povećavale su se proporcionalno u rasponu doza od 2,5 do 400 mg. Nakon peroralne doze 5 mg saksagliptina za zdrave ispitanice, srednje vrijednosti AUC plazme za saksagliptin i njegov aktivni metabolit bile su 78 ng-h / mL i 214 ng-h / mL, respektivno. Odgovarajuća plazma Cmaksimum vrijednosti su bile 24 ng / mL, odnosno 47 ng / mL, respektivno. Prosječna varijabilnost (% CV) za AUC i Cmaksimum i za saksagliptin i njegov aktivni metabolit bio je manji od 25%.
Nije primijećeno značajno nakupljanje saksagliptina ili njegovog aktivnog metabolita uz opetovano doziranje jednom dnevno u bilo kojoj razini doze. Nisu primijećene ovisnosti o dozi i vremenu u klirensu saksagliptina i njegovog aktivnog metabolita tijekom 14 dana doziranja jednom dnevno, u dozi od 2,5 do 400 mg.
apsorpcija
Medijan vremena do maksimalne koncentracije (Tmaksimum) nakon doze od 5 mg jednom dnevno bilo je 2 sata za saksagliptin i 4 sata za njegov aktivni metabolit. Primjena obroka s visokim udjelom masti rezultirala je porastom Tmaksimum saksagliptina za otprilike 20 minuta u odnosu na teška stanja. Došlo je do povećanja AUC saksagliptina za 27% kada se daje obrokom u usporedbi s teškim uvjetima. Onglyza se može primijeniti sa ili bez hrane.
Distribucija
In vitro vezanje proteina saksagliptina i njegovog aktivnog metabolita u ljudskom serumu je zanemarivo. Stoga se ne očekuje da će promjene razine proteina u krvi u raznim bolesnim stanjima (npr. Oštećenje bubrega ili jetre) mijenjati raspoloženje saksagliptina.
Metabolizam
Metabolizam saksagliptina prvenstveno je posredovan citokromom P450 3A4 / 5 (CYP3A4 / 5). Glavni metabolit saksagliptina je također inhibitor DPP4, koji je upola jači kao saksagliptin. Stoga će snažni inhibitori i induktori CYP3A4 / 5 izmijeniti farmakokinetiku saksagliptina i njegovog aktivnog metabolita. [Vidjeti Interakcije s lijekovima.]
Izlučivanje
Saksagliptin se eliminira i putem bubrežnih i jetrenih putova. Nakon pojedinačne doze od 50 mg 14C-saksagliptin, 24%, 36%, i 75% doze izlučeno je u urinu kao saksagliptin, njegov aktivni metabolit i ukupna radioaktivnost. Prosječni bubrežni klirens saksagliptina (~ 230 mL / min) bio je veći od prosječne procijenjene brzine glomerularne filtracije (~ 120 mL / min), što ukazuje na aktivno bubrežno izlučivanje. Ukupno 22% primijenjene radioaktivnosti prikupljeno je u izmetu koji predstavlja udio doze saksagliptina izlučenog u žuči i / ili neapsorbirani lijek iz gastrointestinalnog trakta. Nakon jednokratne oralne doze Onglyza 5 mg za zdrave ispitanice, srednji poluživot u plazmi (t1/2) za saksagliptin i njegov aktivni metabolit bio je 2,5, odnosno 3,1 sat.
Specifične populacije
Oštećenje bubrega
Provedeno je otvoreno istraživanje s jednom dozom kako bi se procijenila farmakokinetika saksagliptina (doza od 10 mg) u ispitanici s različitim stupnjem kroničnog oštećenja bubrega (N = 8 po skupini) u usporedbi s ispitanicima s normalnim bubrežnim oštećenjem funkcija. Studija je obuhvatila bolesnike s oštećenjem bubrega koji su na temelju klirensa kreatinina klasificirani kao blagi (> 50 do ¤ 80 ° mL / min), umjerene (30 do ¤ ¤50 mL / min) i teške (<30 mL / min), kao i pacijenti s krajnjim stadijem bubrega na hemodijaliza. Klirens kreatinina procijenjen je iz kreatinina u serumu na temelju Cockcroft-Gault formule:
CrCl = [140 â & # x20AC; & # x201C; starost (godina)] Ã - težina (kg) {Ã - 0,85 za ženske pacijente}
[72 Ã - kreatinin u serumu (mg / dL)]
Stupanj oštećenja bubrega nije utjecao na Cmaksimum saksagliptina ili njegovog aktivnog metabolita. U ispitanika s blagim oštećenjem bubrega, AUC vrijednosti saksagliptina i njegovog aktivnog metabolita bile su za 20% i 70% veće od AUC vrijednosti u ispitanika s normalnom bubrežnom funkcijom. Budući da se povećanja ove veličine ne smatraju klinički relevantnim, ne preporučuje se prilagođavanje doze u bolesnika s blagim oštećenjem bubrega. U ispitanika s umjerenim ili teškim oštećenjem bubrega, AUC vrijednosti saksagliptina i njegovog aktivnog djelovanja metaboliti su bili do 2,1- i 4,5 puta veći od AUC vrijednosti kod ispitanika s normalnom renalnom vrijednosti funkcija. Da bi se postigla izloženost saksagliptina u plazmi i njegovog aktivnog metabolita slična onima u bolesnika s normalnom funkcijom bubrega, preporučena doza je 2,5 mg jednom dnevno u bolesnika s umjerenim i teškim oštećenjem bubrega, kao i u bolesnika s bubrežnom bolešću u završnom stadiju koji zahtijevaju hemodijaliza. Saksagliptin se uklanja hemodijalizom.
Oštećenje jetre
U ispitanika s oštećenjem jetre (Child-Pugh razred A, B i C) znači Cmaksimum AUC saksagliptina bila je i do 8% odnosno 77% veća, u usporedbi sa zdravim podudarnim kontrolama nakon davanja jedne doze 10 mg saksagliptina. Odgovarajući Cmaksimum AUC aktivnog metabolita bio je i do 59% i 33% niži, u usporedbi sa kontrolnim kontrolnim skupinama zdravih. Te se razlike ne smatraju klinički značajnim. Ne preporučuje se prilagođavanje doze za pacijente s oštećenjem jetre.
Indeks tjelesne mase
Ne preporučuje se prilagođavanje doze na temelju indeksa tjelesne mase (BMI) koji nije identificiran kao značajan kovariati na očigledan klirens saksagliptina ili njegovog aktivnog metabolita u populacijskoj farmakokinetičkoj tvari analiza.
rod
Ne preporučuje se prilagođavanje doze na temelju spola. Nisu uočene razlike u farmakokinetikama saksagliptina između muškaraca i žena. U usporedbi s muškarcima, žene su imale otprilike 25% veće vrijednosti izloženosti aktivnom metabolitu u odnosu na muškarce, ali ta razlika vjerojatno neće biti od kliničke važnosti. Pol nije utvrđen kao značajan kovarijat na očigledan klirens saksagliptina i njegovog aktivnog metabolita u populacijskoj farmakokinetičkoj analizi.
gerijatrijske
Ne preporučuje se prilagođavanje doze na temelju samo dobi. Stariji ispitanici (65-80 godina) imali su 23% i 59% veću geometrijsku sredinu Cmaksimum i geometrijske srednje AUC vrijednosti za saksagliptin, odnosno kod mladih ispitanika (18-40 godina). Razlike u farmakokinetici aktivnog metabolita između starijih i mladih ispitanika uglavnom odražavaju razlike uočene u farmakokinetiki saksagliptina. Razlika između farmakokinetike saksagliptina i aktivnog metabolita u mladih i starijih osoba ispitanika je vjerojatno zbog više faktora, uključujući smanjenje bubrežne funkcije i metaboličke sposobnosti s povećanje dobi. Dob nije identificiran kao značajan kovarijat na očigledan klirens saksagliptina i njegovog aktivnog metabolita u populacijskoj farmakokinetičkoj analizi
pedijatrijski
Ispitivanja koja su karakterizirala farmakokinetiku saksagliptina u pedijatrijskih bolesnika nisu provedena.
Rasa i nacionalnost
Ne preporučuje se prilagođavanje doze na temelju rase. Populacijska farmakokinetička analiza uspoređivala je farmakokinetiku saksagliptina i njegovog aktivnog metabolit u 309 kavkaških ispitanika sa 105 nekavkaskih subjekata (koji se sastoji od šest rasnih skupina). Nisu utvrđene značajne razlike u farmakokinetikama saksagliptina i njegovog aktivnog metabolita između ove dvije populacije.
Interakcije lijekova i droga
In vitro procjena interakcija lijekova
Metabolizam saksagliptina prvenstveno je posredovan CYP3A4 / 5.
U in vitro studijama saksagliptin i njegov aktivni metabolit nisu inhibirali CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 ili 3A4, niti inducirali CYP1A2, 2B6, 2C9 ili 3A4. Stoga se ne očekuje da saksagliptin mijenja metabolički klirens istodobnih lijekova koji se metaboliziraju pomoću tih enzima. Saksagliptin je supstrat P-glikoproteina (P-gp), ali nije značajan inhibitor ili induktor P-gp.
In vitro vezanje proteina saksagliptina i njegovog aktivnog metabolita u ljudskom serumu je zanemarivo. Dakle, vezivanje proteina ne bi imalo značajnog utjecaja na farmakokinetiku saksagliptina ili drugih lijekova.
In vivo procjena interakcija lijekova
Učinci Saxagliptina na ostale lijekove
U studijama provedenim na zdravim ispitanicima, kao što je opisano u daljnjem tekstu, saksagliptin nije na značajan način promijenio onu farmakokinetika metformina, gliburida, pioglitazona, digoksina, simvastatina, diltiazema ili ketokonazola.
Metformin: Istodobna primjena jednostruke doze saksagliptina (100 mg) i metformina (1000 mg), supstrata hOCT-2, nije promijenila farmakokinetiku metformina kod zdravih ispitanika. Stoga, Onglyza nije inhibitor transporta posredovanog hOCT-2.
Glyburide: Istodobna primjena jednostruke doze saksagliptina (10 mg) i gliburida (5 mg), supstrata CYP2C9, povećala je plazmu Cmaksimum glikurida za 16%; međutim, AUC gliburida je bila nepromijenjena. Stoga, Onglyza ne znači značajno inhibirati metabolizam posredovan CYP2C9.
Pioglitazon: Istodobna primjena višestrukih doza saksagliptina (10 mg) i pioglitazona (45 mg), supstrata CYP2C8, povećala je plazmu Cmaksimum pioglitazona za 14%; međutim, AUC pioglitazona bio je nepromijenjen.
Digoksin: Istodobna primjena višestrukih doza saksagliptina (10 mg) i digoksina (0,25 mg), supstrata P-gp, nije promijenila farmakokinetiku digoksina. Stoga, Onglyza nije inhibitor ili induktor transporta posredovanog P-gp-om.
Simvastatin: Istodobna primjena višestrukih doza saksagliptina (10 mg) i simvastatina (40 mg), supstrata CYP3A4 / 5, nije promijenila farmakokinetiku simvastatina. Stoga, Onglyza nije inhibitor ili induktor metabolizma posredovanog CYP3A4 / 5.
Diltiazem: Istodobna primjena višestrukih doza saksagliptina (10 mg) i diltiazema (360 mg dugotrajno djelovanje u stanju stabilnosti), umjereni inhibitor CYP3A4 / 5, povećala je plazmu Cmaksimum diltiazima za 16%; međutim, AUC diltiazima bila je nepromijenjena.
Ketokonazol: Istodobna primjena jednostruke doze saksagliptina (100 mg) i višestrukih doza ketokonazola (200 mg svakih 12 sati u stabilno stanje), snažni inhibitor CYP3A4 / 5 i P-gp, smanjio je plazma Cmax i AUC ketokonazola za 16% i 13%, odnosno.
Učinci drugih lijekova na saksagliptin
Metformin: Istodobna primjena jednostruke doze saksagliptina (100 mg) i metformina (1000 mg), hOCT-2 supstrata, smanjila je Cmaksimum saksagliptina za 21%; međutim, AUC je bio nepromijenjen.
Glyburide: Istodobna primjena jednostruke doze saksagliptina (10 mg) i gliburida (5 mg), supstrata CYP2C9, povećala jemaksimum saksagliptina za 8%; međutim, AUC saksagliptina je bio nepromijenjen.
Pioglitazon: Istodobna primjena višestrukih doza saksagliptina (10 mg) i pioglitazona (45 mg), supstrat CYP2C8 (glavni) i CYP3A4 (manji), nisu promijenili farmakokinetiku saksagliptin.
Digoksin: Istodobna primjena višestrukih doza saksagliptina (10 mg) i digoksina (0,25 mg), supstrata P-gp, nije promijenila farmakokinetiku saksagliptina.
Simvastatin: Istodobna primjena višestrukih doza saksagliptina (10 mg) i simvastatina (40 mg), supstrata CYP3A4 / 5, povećala je Cmaksimum saksagliptina za 21%; međutim, AUC saksagliptina je bio nepromijenjen.
Diltiazem: Istodobna primjena jednostruke doze saksagliptina (10 mg) i diltiazema (360 mg formulacija dugog djelovanja u ustaljenom stanju), umjereni inhibitor CYP3A4 / 5, povećala je Cmaksimum saksagliptina za 63% i AUC 2,1 puta. To je povezano s odgovarajućim smanjenjem Cmaksimum i AUC aktivnog metabolita za 44%, odnosno 36%, respektivno.
Ketokonazol: Istodobna primjena jednostruke doze saksagliptina (100 mg) i ketokonazola (200 mg u 12 sati u stanju dinamičke ravnoteže), snažnog inhibitora CYP3A4 / 5 i P-gp, povećala je Cmaksimum za saksagliptin za 62% i AUC za 2,5 puta. To je povezano s odgovarajućim smanjenjem Cmaksimum i AUC aktivnog metabolita za 95%, odnosno 91%.
U drugom istraživanju, istodobna primjena jednostruke doze saksagliptina (20 mg) i ketokonazola (200 mg svakih 12 sati u stanju pripravnosti) povećala je Cmaksimum i AUC saksagliptina 2,4 puta i 3,7 puta. To je povezano s odgovarajućim smanjenjem Cmaksimum i AUC aktivnog metabolita za 96%, odnosno 90%, respektivno.
Rifampin: Istodobna primjena jednostruke doze saksagliptina (5 mg) i rifampina (600 mg QD u stanju mirovanja) smanjila je Cmaksimum i AUC saksagliptina za 53%, odnosno 76%, s odgovarajućim porastom Cmaksimum (39%), ali bez značajnih promjena u plazmi AUC aktivnog metabolita.
Omeprazol: Istodobna primjena višestrukih doza saksagliptina (10 mg) i omeprazola (40 mg), CYP2C19 (glavni) i supstrat CYP3A4, inhibitor CYP2C19 i induktor MRP-3, nisu promijenili farmakokinetiku saksagliptin.
Aluminij hidroksid + magnezijev hidroksid + simetikon: Istodobna primjena jedne doze saksagliptina (10 mg) i tekućina koja sadrži aluminij hidroksid (2400 mg), magnezijev hidroksid (2400 mg) i simetikon (240 mg) smanjili su Cmaksimum saksagliptina za 26%; međutim, AUC saksagliptina je bio nepromijenjen.
Famotidin: Primjena jedne doze saksagliptina (10 mg) 3 sata nakon jednostruke doze famotidina (40 mg), inhibitora hOCT-1, hOCT-2 i hOCT-3, povećao Cmaksimum saksagliptina za 14%; međutim, AUC saksagliptina je bio nepromijenjen.
vrh
Neklinička toksikologija
Kancerogeneza, mutageneza, oštećenje plodnosti
Saksagliptin nije izazvao tumore ni kod miševa (50, 250 i 600 mg / kg), ni kod štakora (25, 75, 150 i 300 mg / kg) u najvećim procjenjivanim dozama. Najveće doze procijenjene na miševima bile su ekvivalentne približno 870 (mužjacima) i 1165 (ženama) većoj od izloženosti čovjeka pri MRHD-u od 5 mg / dan. U štakora su izloženosti otprilike 355 (mužjaci) i 2217 (žene) više od MRHD-a.
Saksagliptin nije bio mutagen ili klastogen sa ili bez metaboličke aktivacije u in vitro ispitivanju Ames bakterija, in vitro ispitivanja citogenetike kod primarnog čovjeka limfociti, in vivo ispitivanje oralnog mikronukleusa u štakora, in vivo ispitivanje popravke oralne DNA u štakora i oralno in vivo / in vitro citogenetika u perifernoj krvi štakora limfociti. Aktivni metabolit nije bio mutagen u in vitro ispitivanju bakterija Ames.
U studiji plodnosti štakora, mužjaci su tretirani oralnim doznim dozama tijekom dva tjedna prije parenja, tijekom parenja i do planiranog razdoblja nakon prekida (otprilike 4 tjedna), a ženke su liječene oralnim doznim dozama tijekom 2 tjedna prije parenja kroz gestaciju dan 7. Nisu primijećeni štetni učinci na plodnost kod izloženosti od približno 603 (mužjaci) i 776 (žene) više od MRHD-a. Veće doze koje su izazivale toksičnost za majku također su povećale resorpciju fetusa (približno 2069 i 6138 puta više od MRHD-a). Dodatni učinci na estro biciklizam, plodnost, ovulaciju i implantaciju primijećeni su približno 6138 puta više od MRHD-a.
Toksikologija životinja
Saksagliptin je stvorio štetne kožne promjene u ekstremitetima majmuna cynomolgus (krasta i / ili ulceracija repa, znamenke, skrotum i / ili nos). Kožne lezije su bile reverzibilne â ¥ 20 puta od MRHD-a, ali u nekim slučajevima ireverzibilne i nekrotiziraju se pri većim izloženostima. Neželjene promjene na koži nisu primijećene kod izloženosti sličnoj (1 do 3 puta) MRHD-u od 5 mg. U kliničkim ispitivanjima saksagliptina na ljudima nisu primijećeni klinički korelati s oštećenjima kože majmuna.
vrh
Kliničke studije
Onglyza je proučavana kao monoterapija i u kombinaciji s terapijom metforminom, gliburidom i tiazolidindionom (pioglitazonom i rosiglitazonom). Onglyza nije ispitivan u kombinaciji s inzulinom.
Ukupno je 4148 bolesnika sa šećernom bolešću tipa 2 randomizirano u šest, dvostruko slijepih, kontroliranih kliničkih ispitivanja provedenih radi procjene sigurnosti i glikemijske učinkovitosti Onglyze. Ukupno 3021 pacijent u tim ispitivanjima liječen je lijekom Onglyza. U tim ispitivanjima prosječna dob bila je 54 godine, a 71% bolesnika je bilo kavkasko, 16% je bilo azijskih, 4% je bilo crno, a 9% je bilo iz ostalih rasnih skupina. Dodatna 423 pacijenta, uključujući 315 koji su primali Onglyzu, sudjelovali su u placebo kontroliranom ispitivanju u rasponu doze u trajanju od 6 do 12 tjedana.
U ova šest, dvostruko slijepa ispitivanja, Onglyza je procijenjena u dozama od 2,5 mg i 5 mg jednom dnevno. U tri su ispitivanja također bila ocijenjena doza saksagliptina od 10 mg dnevno. Dnevna doza 10 mg saksagliptina nije dala veću učinkovitost od dnevne doze od 5 mg. Liječenje Onglyzom u svim dozama proizvelo je klinički relevantna i statistički značajna poboljšanja hemoglobina A1c (A1C), glukoza u plazmi natašte (FPG) i dvosatna postprandialna glukoza (PPG) nakon standardnog oralnog testa tolerancije na glukozu (OGTT), u usporedbi s kontrolirati. Smanjenja vrijednosti A1C zabilježena su u podskupinama, uključujući spol, dob, rasu i početni BMI.
Onglyza nije bila povezana s značajnim promjenama u odnosu na početnu vrijednost tjelesne težine ili lipidima u serumu nakon posta u odnosu na placebo.
monoterapija
Ukupno 766 bolesnika s dijabetesom tipa 2 neadekvatno kontrolirano dijetom i vježbanjem (A1C od 7% do 10%) sudjelovao u dva, dvostruko slijepa, placebo kontrolirana ispitivanja u trajanju od 24 tjedna, ocjenjujući učinkovitost i sigurnost Onglyza monoterapija.
U prvom ispitivanju, nakon dvotjedne prehrane, vježbanja i razdoblja uvođenja placeba, 401 pacijent je nasumično odabran na 2,5 mg, 5 mg ili 10 mg Onglyze ili placeba. Pacijenti koji nisu postigli određene ciljeve glikemije tijekom ispitivanja liječeni su spasilačkom terapijom metforminom, dodani na placebo ili Onglyza. Učinkovitost je procijenjena na posljednjem mjerenju prije terapije spašavanja za pacijente kojima je potreban spas. Titriranje doze Onglyza nije dopušteno.
Tretman 2,5 mg i 5 mg Onglyze dnevno osigurao je značajna poboljšanja A1C, FPG i PPG u usporedbi s placebom (Tablica 3). Postotak pacijenata koji su prekinuli zbog nedostatka glikemijske kontrole ili su spašeni zbog unaprijed utvrđenog sastanka glikemijski kriterij bio je 16% u skupini liječenja Onglyza 2,5 mg, 20% u skupini liječenja Onglyza 5 mg i 26% u skupini liječenja Onglyza placebo grupa.
Tablica 3: Glikemijski parametri u 24. tjednu u placebo kontroliranom istraživanju monoterapije Onglyza u bolesnika s dijabetesom tipa 2 *
| Parametar učinkovitosti | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Populacija koja namjerava liječiti koristeći posljednje promatranje na studiji ili posljednje promatranje prije spašavanja metforminske terapije za pacijente kojima je potreban spas. | |||
| †Srednji kvadrati srednje vrijednosti prilagođeni osnovnoj vrijednosti. | |||
| c p-vrijednost <0.0001 u usporedbi s placebom | |||
| § p-vrijednost <0,05 u usporedbi s placebom | |||
| ¶ Značajnost nije testirana na dvosatni PPG za dozu 2,5 mg Onglyza. | |||
| Hemoglobin A1C (%) | N = 100 | N = 103 | N = 92 |
| Polazna vrijednost (prosjek) | 7.9 | 8.0 | 7.9 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −0.4 | −0.5 | +0.2 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −0.6c | −0.6c | |
| 95% interval povjerenja | (−0.9, −0.3) | (−0.9, −0.4) | |
| Postotak pacijenata koji postižu A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Plazma glukoza nakon posta (mg / dL) | N = 101 | N = 105 | N = 92 |
| Polazna vrijednost (prosjek) | 178 | 171 | 172 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −15 | −9 | +6 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −21 § | −15 § | |
| 95% interval povjerenja | (−31, −10) | (−25, −4) | |
| Dvosatna postprandialna glukoza (mg / dL) | N = 78 | N = 84 | N = 71 |
| Polazna vrijednost (prosjek) | 279 | 278 | 283 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −45 | −43 | −6 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −39 ¶ | −37 § | |
| 95% interval povjerenja | (−61, −16) | (−59, −15) |
Provedeno je drugo ispitivanje monoterapije u trajanju od 24 tjedna kako bi se procijenio raspon režima doziranja za Onglyzu. Naivno liječeni bolesnici s neadekvatno kontroliranim dijabetesom (A1C ‰ ¥ ¥% ¤ ¤ 10%) bili su podvrgnuti dvotjednom, slijepoj prehrani, vježbanju i uvođenju placeba. Ukupno 365 bolesnika randomizirano je na 2,5 mg svako jutro, 5 mg svako jutro, 2,5 mg s mogućom titracijom do 5 mg svako jutro, ili 5 mg svake večeri Onglyza, ili placeba. Pacijenti koji nisu postigli specifične glikemijske ciljeve tijekom ispitivanja liječeni su terapijom za spašavanje metformina dodanom placebu ili Onglyza; broj pacijenata randomiziranih po skupini liječenja kretao se u rasponu od 71 do 74.
Tretman s 5 mg Onglyza svako jutro ili 5 mg svake večeri donio je značajna poboljšanja u A1C u odnosu na placebo (prosječne redukcije placeba korigirane od 0,4% i 0,3% respektivno). Tretman s 2,5 mg Onglyze svako jutro također je omogućio značajno poboljšanje vrijednosti A1C u odnosu na placebo (prosječno smanjenje korijena placeba od 0,4%).
Kombinirana terapija
Dodatna kombinirana terapija s metforminom
U ovom 24-tjednom, nasumičnom, dvostruko slijepom, placebo kontroliranom ispitivanju sudjelovala su 743 pacijenta s dijabetesom tipa 2 kako bi se procijenila djelotvornost i sigurnost lijeka Onglyza u kombinaciji s metforminom u bolesnika s neadekvatnom kontrolom glikemije (A1C ‰ ¥%% ¤ 10%) na metforminu sama. Kako bi se kvalificirali za upis, pacijenti su trebali uzimati stabilnu dozu metformina (1500-2550 mg dnevno) najmanje 8 tjedana.
Pacijenti koji su zadovoljili kriterije prihvatljivosti bili su uključeni u jedno slijepo, dvotjedno dijetetsko i vježbanje placebo uvod razdoblje tijekom kojeg su pacijenti primali metformin u dozi prije ispitivanja, do 2500 mg dnevno, u trajanju od studij. Nakon uvodnog razdoblja, prihvatljivi bolesnici randomizirani su na 2,5 mg, 5 mg ili 10 mg Onglyze ili placeba uz trenutnu dozu otvorenog metformina. Pacijenti koji nisu postigli određene ciljeve glikemije tijekom ispitivanja liječeni su spasilačkom terapijom pioglitazonom, dodani postojećim lijekovima za ispitivanje. Titriranje doze Onglyze i metformina nije dopušteno.
Dodaci onglyza 2,5 mg i 5 mg meforminu pružili su značajna poboljšanja u A1C, FPG i PPG u usporedbi s dodatkom placeba na metformin (Tablica 4). Srednje promjene od početne vrijednosti za A1C tijekom vremena i do krajnje točke prikazane su na slici 1. Udio bolesnika koji su prekinuli zbog nedostatka glikemijske kontrole ili su spašeni zbog ispunjavanja unaprijed utvrđenih glikemijskih kriterija bio je 15% u dodatku Onglyza od 2,5 mg metforminskoj skupini, 13% u dodatku Onglyza od 5 mg u skupini s metforminom, a 27% u dodatku placebo-a na metformin skupina.
Tablica 4: Glikemijski parametri u 24. tjednu u placebo kontroliranom ispitivanju onglyze kao dodatnog kombiniranog liječenja metforminom *
| Parametar učinkovitosti | Onglyza 2,5 mg + metformin N = 192 |
Onglyza 5 mg + metformin N = 191 |
Placebo + metformin N = 179 |
|---|---|---|---|
| * Populacija koja namjerava liječiti koristeći posljednje promatranje na studiji ili posljednje promatranje prije terapije spašavanja pioglitazona za pacijente kojima je potreban spas. | |||
| †Srednji kvadrati srednje vrijednosti prilagođeni osnovnoj vrijednosti. | |||
| c p-vrijednost <0.0001 u usporedbi s placebom + metforminom | |||
| § p-vrijednost <0,05 u odnosu na placebo + metformin | |||
| Hemoglobin A1C (%) | N = 186 | N = 186 | N = 175 |
| Polazna vrijednost (prosjek) | 8.1 | 8.1 | 8.1 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −0.6 | −0.7 | +0.1 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −0.7c | −0.8c | |
| 95% interval povjerenja | (−0.9, −0.5) | (−1.0, −0.6) | |
| Postotak pacijenata koji postižu A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Plazma glukoza nakon posta (mg / dL) | N = 188 | N = 187 | N = 176 |
| Polazna vrijednost (prosjek) | 174 | 179 | 175 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −14 | −22 | +1 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −16 § | −23 § | |
| 95% interval povjerenja | (−23, −9) | (−30, −16) | |
| Dvosatna postprandialna glukoza (mg / dL) | N = 155 | N = 155 | N = 135 |
| Polazna vrijednost (prosjek) | 294 | 296 | 295 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −62 | −58 | −18 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −44 § | −40 § | |
| 95% interval povjerenja | (−60, −27) | (−56, −24) |
Slika 1: Srednja promjena od polazne vrijednosti u A1C-u u pokusu s kontroliranom placebom s Onglyza kao dodatnom kombiniranom terapijom metforminom *

* Uključuje bolesnike s početnom vrijednosti i vrijednosti od 24. tjedna.
24. tjedan (LOCF) uključuje populaciju namijenjenu liječenju koristeći posljednje promatranje ispitivanja prije terapije spašavanja pioglitazona za pacijente kojima je potreban spas. Srednja promjena od osnovne vrijednosti prilagođava se osnovnoj vrijednosti.
Dodatna kombinirana terapija s tiazolidindionom
U ovom 24-tjednom, nasumičnom, dvostruko slijepom, placebo kontroliranom ispitivanju sudjelovalo je 565 bolesnika s dijabetesom tipa 2 kako bi se procijenila djelotvornost i sigurnost lijeka Onglyza u kombinaciji s tiazolidindionom (TZD) u bolesnika s neadekvatnom kontrolom glikemije (A1C od 7% do 10,5%) na TZD sama. Kako bi se kvalificirali za upis, pacijenti su trebali uzimati stabilnu dozu pioglitazona (30-45 mg jednom dnevno) ili rosiglitazon (4 mg jednom dnevno ili 8 mg jednom dnevno ili u dvije podijeljene doze od 4 mg) najmanje 12 tjedni.
Pacijenti koji su zadovoljili kriterije prihvatljivosti bili su uključeni u jedno slijepo, dvotjedno dijete, vježbanje razdoblje uvođenja placeba tijekom kojeg su pacijenti primali TZD u dozi prije ispitivanja za vrijeme trajanja terapije studij. Nakon početnog razdoblja, prihvatljivi pacijenti su nasumično raspoređeni na 2,5 mg ili 5 mg Onglyze ili placeba, uz trenutnu dozu TZD. Pacijenti koji nisu postigli određene ciljeve glikemije tijekom ispitivanja liječeni su spašavanjem metformina, dodani postojećim lijekovima za ispitivanje. Titracija doze Onglyza ili TZD nije dopuštena tijekom ispitivanja. Promjena režima TZD-a iz rosiglitazona u pioglitazon u određenim, ekvivalentnim terapijskim dozama dozvoljena je, prema nahođenju istražitelja, ako se vjeruje da je to medicinski prikladno.
Dodatak Onglyza 2,5 mg i 5 mg TZD-u pružio je značajna poboljšanja u A1C, FPG i PPG u usporedbi s dodatkom placeba na TZD (tablica 5). Udio bolesnika koji su prekinuli zbog nedostatka glikemijske kontrole ili su spašeni zbog ispunjavanja unaprijed utvrđenih glikemijskih kriterija bilo je 10% u dodatku Onglyza 2,5 mg u TZD skupini, 6% u dodatku Onglyza od 5 mg na TZD skupinu, i 10% u dodatku placebo na TZD skupina.
Tablica 5: Glikemijski parametri u 24. tjednu u placebo kontroliranom ispitivanju onglyze kao dodatnog kombiniranog liječenja s tiazolidindionom *
| Parametar učinkovitosti | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Populacija koja namjerava liječiti koristeći posljednje promatranje na studiji ili posljednje promatranje prije spašavanja metforminske terapije za pacijente kojima je potreban spas. | |||
| †Srednji kvadrati srednje vrijednosti prilagođeni osnovnoj vrijednosti. | |||
| c p-vrijednost <0.0001 u usporedbi s placebom + TZD | |||
| § p-vrijednost <0,05 u usporedbi s placebom + TZD | |||
| Hemoglobin A1C (%) | N = 192 | N = 183 | N = 180 |
| Polazna vrijednost (prosjek) | 8.3 | 8.4 | 8.2 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −0.7 | −0.9 | −0.3 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −0.4 § | −0.6c | |
| 95% interval povjerenja | (−0.6, −0.2) | (−0.8, −0.4) | |
| Postotak pacijenata koji postižu A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Plazma glukoza nakon posta (mg / dL) | N = 193 | N = 185 | N = 181 |
| Polazna vrijednost (prosjek) | 163 | 160 | 162 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −14 | −17 | −3 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −12 § | −15 § | |
| 95% interval povjerenja | (−20, −3) | (−23, −6) | |
| Dvosatna postprandialna glukoza (mg / dL) | N = 156 | N = 134 | N = 127 |
| Polazna vrijednost (prosjek) | 296 | 303 | 291 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −55 | −65 | −15 |
| Razlika od placeba (prilagođena srednja vrijednost)†) | −40 § | −50 § | |
| 95% interval povjerenja | (−56, −24) | (−66, −34) |
Dodatna kombinirana terapija s gliburidom
U ovom 24-tjednom, randomiziranom, dvostruko slijepom, placebo kontroliranom ispitivanju sudjelovalo je 768 pacijenata s dijabetesom tipa 2 kako bi se procijenila učinkovitost i sigurnost Onglyza u kombinaciji sa sulfonilureom (SU) u bolesnika s neadekvatnom kontrolom glikemije pri upisu (A1C ‰ ¥ ‰ 7% do ¤ ¤ 10%) na submaksimalnoj dozi SU sama. Da bi se kvalificirali za upis, pacijenti su trebali primati submaksimalnu dozu SU 2 mjeseca ili više. U ovoj studiji, Onglyza je u kombinaciji s fiksnom, intermedijarnom dozom SU uspoređivan s titracijom s većom dozom SU.
Pacijenti koji su zadovoljili kriterije prihvatljivosti bili su uključeni u jedno slijepo, četverosjedno, dijetetsko i vježbanje, a stavljali su ih na gliburid 7,5 mg jednom dnevno. Nakon početnog razdoblja, bolesnici s A1C-om od 7% do 10% randomizirali su se na 2,5 mg ili 5 mg dodatka Onglyza na 7,5 mg gliburida ili na placebo plus ukupnu dnevnu dozu od 10 mg gliburid. Pacijenti koji su primali placebo mogli su imati titrirani gliburid na ukupnu dnevnu dozu od 15 mg. Povišena titracija gliburida nije dopuštena u bolesnika koji su primali Onglyza 2,5 mg ili 5 mg. U bilo kojoj skupini liječenja gliburid se može podnijeti titraji jednom tijekom razdoblja od 24 tjedna zbog hipoglikemije koju istražitelj smatra potrebnom. Otprilike 92% bolesnika u skupini s placebom i gliburidom povišeno je titrirano na konačnu ukupnu dnevnu dozu od 15 mg tijekom prva 4 tjedna razdoblja ispitivanja. Pacijenti koji nisu postigli određene ciljeve glikemije tijekom ispitivanja liječeni su spašavanjem metformina, dodani postojećim lijekovima za ispitivanje. Titriranje doze Onglyza nije dopušteno tijekom ispitivanja.
U kombinaciji s gliburidom, Onglyza 2,5 mg i 5 mg donio je značajna poboljšanja u A1C, FPG i PPG u usporedbi s placebom plus gore titriranom gliburidnom skupinom (Tablica 6). Udio bolesnika koji su prekinuli zbog nedostatka glikemijske kontrole ili su spašeni zbog ispunjavanja unaprijed određenih glikemijskih kriterija bio je 18% u dodatak Onglyza 2,5 mg u gliburidnu skupinu, 17% u dodatku Onglyza od 5 mg na gliburidnu skupinu i 30% u placebo plus povišeni titrirani gliburid skupina.
Tablica 6: Glikemijski parametri u 24. tjednu u placebo kontroliranom ispitivanju onglyze kao dodatnog kombiniranog liječenja glyburidom *
| Parametar učinkovitosti | Onglyza 2,5 mg + gliburid 7,5 mg N = 248 |
Onglyza 5 mg + gliburid 7,5 mg N = 253 |
Placebo + Gliburide s titrom N = 267 |
|---|---|---|---|
| * Populacija koja namjerava liječiti koristeći posljednje promatranje na studiji ili posljednje promatranje prije spašavanja metforminske terapije za pacijente kojima je potreban spas. | |||
| †Srednji kvadrati srednje vrijednosti prilagođeni osnovnoj vrijednosti. | |||
| c p-vrijednost <0.0001 u usporedbi s placebom + povišeni titrirani gliburid | |||
| § p-vrijednost <0,05 u usporedbi s placebom + povišeni titrirani gliburid | |||
| Hemoglobin A1C (%) | N = 246 | N = 250 | N = 264 |
| Polazna vrijednost (prosjek) | 8.4 | 8.5 | 8.4 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −0.5 | −0.6 | +0.1 |
| Razlika od titriranog gliburida (prilagođeni prosjek†) | −0.6c | −0.7c | |
| 95% interval povjerenja | (−0.8, −0.5) | (−0.9, −0.6) | |
| Postotak pacijenata koji postižu A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Plazma glukoza nakon posta (mg / dL) | N = 247 | N = 252 | N = 265 |
| Polazna vrijednost (prosjek) | 170 | 175 | 174 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −7 | −10 | +1 |
| Razlika od titriranog gliburida (prilagođeni prosjek†) | −8 § | −10 § | |
| 95% interval povjerenja | (−14, −1) | (−17, −4) | |
| Dvosatna postprandialna glukoza (mg / dL) | N = 195 | N = 202 | N = 206 |
| Polazna vrijednost (prosjek) | 309 | 315 | 323 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −31 | −34 | +8 |
| Razlika od titriranog gliburida (prilagođeni prosjek†) | −38 § | −42 § | |
| 95% interval povjerenja | (−50, −27) | (−53, −31) |
Istodobna primjena metformina u bolesnika koji nisu na liječenju
U ovom 24-tjednom, nasumičnom, dvostruko slijepom, placebo kontroliranom ispitivanju sudjelovalo je 1306 naivnih bolesnika sa šećernom bolešću tipa 2. procijeniti djelotvornost i sigurnost uzimanja lijeka Onglyza s metforminom u bolesnika s neadekvatnom kontrolom glikemije (A1C ‰ ¥% â ¤ ¤12%) na dijeti i tjelovježbi sama. Pacijenti su morali biti naivni za liječenje kako bi bili uključeni u ovo istraživanje.
Pacijenti koji su zadovoljili kriterije prihvatljivosti bili su uključeni u razdoblje uvođenja pojedinačno slijepog, tjednog prehrane i vježbanja placeba. Bolesnici su nasumično odabrani u jednu od četiri skupine liječenja: Onglyza 5 mg + metformin 500 mg, saksagliptin 10 mg + metformin 500 mg, saksagliptin 10 mg + placebo ili metformin 500 mg + placebo. Onglyza se dozirao jednom dnevno. U 3 skupine liječenja koje su koristile metformin, doza metformina povećavala se tjedno s povećanjem od 500 mg na dan, kako se podnosi, na maksimalno 2000 mg dnevno na temelju FPG. Pacijenti koji tijekom ispitivanja nisu postigli određene ciljeve glikemije liječeni su pioglitazonom kao dodatna terapija.
Istodobna primjena Onglyza 5 mg plus metformin osigurala je značajna poboljšanja u A1C, FPG i PPG u usporedbi s placebom plus metforminom (Tablica 7).
Tablica 7: Glikemijski parametri u 24. tjednu u pokusu istodobne primjene Onglyza s metforminom u bolesnika koji nisu na liječenju.
| Parametar učinkovitosti | Onglyza 5 mg + metformin N = 320 |
Placebo + metformin N = 328 |
|---|---|---|
| * Populacija koja namjerava liječiti koristeći posljednje promatranje na studiji ili posljednje promatranje prije terapije spašavanja pioglitazona za pacijente kojima je potreban spas. | ||
| †Srednji kvadrati srednje vrijednosti prilagođeni osnovnoj vrijednosti. | ||
| c p-vrijednost <0.0001 u usporedbi s placebom + metforminom | ||
| § p-vrijednost <0,05 u odnosu na placebo + metformin | ||
| Hemoglobin A1C (%) | N = 306 | N = 313 |
| Polazna vrijednost (prosjek) | 9.4 | 9.4 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −2.5 | −2.0 |
| Razlika od placeba + metformina (prilagođeni prosjek†) | −0.5c | |
| 95% interval povjerenja | (−0.7, −0.4) | |
| Postotak pacijenata koji postižu A1C <7% | 60% §(185/307) | 41% (129/314) |
| Plazma glukoza nakon posta (mg / dL) | N = 315 | N = 320 |
| Polazna vrijednost (prosjek) | 199 | 199 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −60 | −47 |
| Razlika od placeba + metformina (prilagođeni prosjek†) | −13 § | |
| 95% interval povjerenja | (−19, −6) | |
| Dvosatna postprandialna glukoza (mg / dL) | N = 146 | N = 141 |
| Polazna vrijednost (prosjek) | 340 | 355 |
| Promjena od početne (prilagođena srednja vrijednost)†) | −138 | −97 |
| Razlika od placeba + metformina (prilagođeni prosjek†) | −41 § | |
| 95% interval povjerenja | (−57, −25) |
vrh
Kako se isporučuje
Onglyza ™ (saksagliptin) tablete imaju oznake s obje strane i dostupne su u jačini i pakiranju navedenom u tablici 8.
| Tableta snaga |
Filmom obložena tableta Boja / oblik |
Tableta oznake |
Veličina Paketa | NDC kod |
|---|---|---|---|---|
| 5 mg | ružičasta dvokonveksni, okrugli |
"5" na jednoj strani i "4215" na poleđini, plavom tintom | Boce od 30 Boce od 90 Boce od 500 Blister od 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | blijedo žuto do svijetložuto dvokonveksni, okrugli |
"2.5" na jednoj strani i "4214" na poleđini, plavom tintom | Boce od 30 Boce od 90 |
0003-4214-11 0003-4214-21 |
Skladištenje i rukovanje
Čuvati na 20 ° -25 ° C (68 ° -77 ° F); izleti dopušteni do 15 ° -30 ° C (vidi temperaturu u sobi s kontroliranom USP-om).
vrh
Ažurirano: 07/09
E.R. Squibb & Sons, L.L.C.
Podaci o pacijentu Onglyza
Detaljne informacije o znakovima, simptomima, uzrocima, liječenjima dijabetesa
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
natrag na: Pregledajte sve lijekove za dijabetes


