Actos za dijabetes tipa 2
Naziv marke: Actos
Opće ime: Pioglitazon hidroklorid
Sadržaj:
Opis
Farmakologija
Indikacije i upotreba
kontraindikacije
Upozorenja
Mjere opreza
Nuspojave
Predozirati
Doziranje i primjena
Kako se isporučuje
Actos, pioglitazone hcl, podaci o pacijentu (na običnom engleskom)
UPOZORENJE: KONGESTIVNA SLIKA SRCA
- Tiazolidindioni, uključujući Actos, kod nekih bolesnika uzrokuju ili pogoršavaju kongestivno zatajenje srca (vidjeti UPOZORENJA). Nakon započinjanja lijeka Actos i nakon povećanja doze, pažljivo promatrajte pacijente zbog znakova i simptoma zatajenja srca (uključujući prekomjerno, brzo debljanje, dispneju i / ili edeme). Ako se ovi znakovi i simptomi razviju, zatajenje srca treba upravljati prema trenutnim standardima skrbi. Nadalje, mora se razmotriti prekid ili smanjenje doze lijeka Actos.
- Actos se ne preporučuje bolesnicima sa simptomatskim zatajenjem srca. Iniciranje Actosa u bolesnika s utvrđenim srčanim zatajenjem NYHA klase III ili IV je kontraindicirano (vidjeti KONTRAINDIKACIJE i UPOZORENJA).
Opis
Actos (pioglitazon hidroklorid) je oralno antidijabetičko sredstvo koje djeluje prvenstveno smanjenjem inzulinske rezistencije. Actos se koristi u liječenju dijabetesa melitusa tipa 2 (poznatog i kao dijabetes melitus neovisan o inzulinu [NIDDM] ili dijabetes koji nastaje kod odraslih). Farmakološke studije pokazuju da Actos poboljšava osjetljivost na inzulin u mišićnom i masnom tkivu i inhibira glukonsogenezu jetre. Actos poboljšava kontrolu glikemije uz smanjenje razine inzulina u cirkulaciji.
Pioglitazon [(±) -5 - [[4- [2- (5-etil-2-piridinil) etoksi] fenil] metil] -2,4-] tiazolidindion monohidroklorid pripada a različita kemijska klasa i ima različita farmakološka djelovanja od sulfonilureje, metformina ili Î--glukozidaze inhibitori. Molekula sadrži jedan asimetrični ugljik, a spoj se sintetizira i koristi kao racemična smjesa. Dva enantiomera pioglitazona međusobno se pretvaraju in vivo. Nisu pronađene razlike u farmakološkoj aktivnosti između dva enantiomera. Strukturna formula je prikazana:
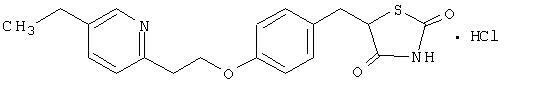
Pioglitazon hidroklorid je bijeli kristalni prah bez mirisa koji ima molekularnu formulu C19H20N2O3S-HCl i molekulska masa 392,90 daltona. Topiv je u N, N-dimetilformamidu, slabo topljiv u bezvodnom etanolu, vrlo slabo topljiv u acetonu i acetonitrilu, praktično netopljiv u vodi i netopiv u eteru.
Actos je dostupan u obliku tableta za oralnu primjenu koji sadrži 15 mg, 30 mg ili 45 mg pioglitazona (kao baze) formuliranog sa slijedeće pomoćne tvari: lAktoza monohidrat NF, hidroksipropilceluloza NF, karboksimetilceluloza kalcij NF i magnezijev stearat NF.
vrh
Klinička farmakologija
Mehanizam djelovanja
Actos je tiazolidindionski antidijabetički agens koji ovisi o prisutnosti inzulina o njegovom mehanizmu djelovanja. Actos smanjuje inzulinsku rezistenciju u periferiji i u jetri što rezultira povećanim odlaganjem glukoze o inzulinu i smanjenim lučenjem glukoze u jetri. Za razliku od sulfonilureje, pioglitazon nije inzulinski sekretagog. Pioglitazon je moćan agonist za peroksisom proliferacijski aktivirani receptor-gama (PPAR3). PPAR receptori nalaze se u tkivima važnim za djelovanje inzulina poput masnog tkiva, skeletnih mišića i jetre. Aktivacija nuklearnih receptora PPARγ modulira transkripciju brojnih gena koji reagiraju na inzulin koji su uključeni u kontrolu metabolizma glukoze i lipida.
U životinjskim modelima dijabetesa pioglitazon smanjuje hiperglikemiju, hiperinzulinemiju i hipertrigliceridemiju karakterističnu za inzulinsko rezistentna stanja poput dijabetesa tipa 2. Metaboličke promjene proizvedene pioglitazonom rezultiraju povećanom reakcijom tkiva ovisnih o inzulinu i primijećene su u brojnim životinjskim modelima otpornosti na inzulin.
Budući da pioglitazon pojačava učinke inzulina koji cirkulira (smanjujući otpornost na inzulin), on ne snižava glukozu u krvi na životinjskim modelima kojima nedostaje endogeni inzulin.
Farmakokinetika i metabolizam lijekova
Serumske koncentracije ukupnog pioglitazona (pioglitazon plus aktivni metaboliti) ostaju povišene 24 sata nakon doziranja jednom dnevno. Serumske koncentracije u ravnotežnom stanju i pioglitazona i ukupnog pioglitazona postižu se u roku od 7 dana. U stanju dinamike ravnoteže, dva farmakološki aktivna metabolita pioglitazona, Metabolites III (M-III) i IV (M-IV), dosežu koncentracije u serumu jednake ili veće od pioglitazona. I u zdravih dobrovoljaca i u bolesnika s dijabetesom tipa 2, pioglitazon sadrži otprilike 30% do 50% maksimalne ukupne koncentracije pioglitazona u serumu i 20% do 25% ukupne površine ispod krivulje koncentracije u vremenu seruma (AUC).
Maksimalna koncentracija u serumu (Cmaksimum), AUC i najniža koncentracija u serumu (Cmin) i za pioglitazon i ukupni pioglitazon proporcionalno povećavaju doze od 15 mg i 30 mg dnevno. Nešto je proporcionalno povećanje pioglitazona i ukupnog pioglitazona u dozi od 60 mg dnevno.
Apsorpcija: Nakon oralne primjene, pioglitazon se najprije može mjeriti u serumu u roku od 30 minuta, a najveće koncentracije opažene su u roku od 2 sata. Hrana malo odgađa vrijeme do vršne koncentracije u serumu na 3 do 4 sata, ali ne mijenja opseg apsorpcije.
Raspodjela: Prosječni prividni volumen raspodjele (Vd / F) pioglitazona nakon primjene jedne doze je 0,63 ± 0,41 (prosjek ± SD) L / kg tjelesne težine.
Pioglitazon se uvelike veže na protein (> 99%) u ljudskom serumu, uglavnom na serumski albumin. Pioglitazon se također vezuje za ostale serumske proteine, ali s nižim afinitetom. Metaboliti M-III i M-IV također su uveliko vezani (> 98%) u albuminu u serumu.
Metabolizam: Pioglitazon se metabolizira u velikoj mjeri hidroksilacijom i oksidacijom; metaboliti se također dijelom pretvaraju u glukuronidne ili sulfatne konjugate. Metaboliti M-II i M-IV (hidroksi derivati pioglitazona) i M-III (keto derivat pioglitazona) farmakološki su aktivni na životinjskim modelima dijabetesa tipa 2. Pored pioglitazona, M-III i M-IV su glavne vrste droga koje se nalaze u ljudskom serumu nakon višestrukog doziranja. U stabilnom stanju, pioglitazon, kod zdravih dobrovoljaca i bolesnika s dijabetesom tipa 2 sadržava otprilike 30% do 50% ukupnih vršnih koncentracija u serumu i 20% do 25% ukupni AUC.
Podaci in vitro pokazuju da je više metabolizma CYP uključeno u metabolizam pioglitazona. Uključeni izoformi citokroma P450 su CYP2C8 i, u manjoj mjeri, CYP3A4 s dodatnim doprinosom raznih drugih izoforma, uključujući uglavnom ekstrahepatički CYP1A1. In vivo provedene su studije pioglitazona u kombinaciji s inhibitorima P450 i supstratima (vidjeti Interakcije s lijekovima). Omjer mokraćnog 6Ã-hidroksikortizola i kortizola izmjeren u bolesnika liječenih Actosom pokazao je da pioglitazon nije snažni induktor CYP3A4 enzima.
Izlučivanje i eliminacija: Nakon oralne primjene, otprilike 15% do 30% doze pioglitazona otkriva se u urinu. Bubrežna eliminacija pioglitazona zanemariva je, a lijek se izlučuje prvenstveno kao metaboliti i njihovi konjugati. Pretpostavlja se da se najveći dio oralne doze izlučuje u žuč bilo u nepromijenjenom obliku ili kao metaboliti i eliminira se iz izmeta.
Srednji poluživot pioglitazona u serumu i ukupni pioglitazon kreću se u rasponu od 3 do 7 sati, odnosno 16 do 24 sata. Pioglitazon ima očigledan klirens, CL / F, računato na 5 do 7 L / hr.
Posebne populacije
Bubrežna insuficijencija: Poluvrijeme eliminacije iz pioglitazona, M-III i M-IV u serumu ostaje nepromijenjeno u bolesnika s umjerenim (klirens kreatinina 30 do 60 ml / min) do teškog (bubrežni klirens <30 ml / min) u usporedbi s normalnim subjekti. Ne preporučuje se prilagođavanje doze u bolesnika s bubrežnom disfunkcijom (vidjeti DOZIRANJE I UPRAVLJANJE).
Jetrna insuficijencija: U usporedbi s normalnim kontrolama, ispitanici s oštećenom funkcijom jetre (Child-Pugh stupanj B / C) imaju približno 45% -tno smanjenje pioglitazona i ukupnih srednjih vršnih koncentracija pioglitazona, ali bez promjene prosječne AUC vrijednosti.
Terapija actosom ne smije se započeti ako pacijent pokaže kliničke dokaze o aktivnoj jetri ili su razine transaminaza u serumu (ALT) veće od 2,5 puta više od gornje granice normale (vidjeti MJERE OPREZA, Jetreni efekti).
Starije osobe: Kod zdravih starijih osoba vršne koncentracije pioglitazona i ukupnog pioglitazona u serumu nisu značajno različite, ali vrijednosti AUC-a su nešto više, a terminalni poluživot malo duži nego za mlađih subjekata. Te promjene nisu bile u veličini koja bi se smatrala klinički relevantnom.
Pedijatrija: Farmakokinetički podaci u pedijatrijskoj populaciji nisu dostupni.
Spol: Srednja vrijednost Cmaksimum i AUC vrijednosti su porasle za 20% do 60% kod žena. Kao monoterapija i u kombinaciji sa sulfonilurejom, metforminom ili inzulinom, Actos je poboljšao kontrolu glikemije i kod muškaraca i kod žena. U kontroliranim kliničkim ispitivanjima hemoglobin A1c (HbA1c) smanjenja od početne vrijednosti općenito su bila veća za žene nego za muškarce (prosječna srednja razlika u HbA)1c 0.5%). Budući da se terapija mora individualizirati za svakog pacijenta kako bi se postigla glikemijska kontrola, ne preporučuje se prilagođavanje doze na temelju samog spola.
Etnička pripadnost: Farmakokinetički podaci među različitim etničkim skupinama nisu dostupni.
Interakcije lijekova i droga
Slijedeći lijekovi proučavani su na zdravim dobrovoljcima uz istodobnu primjenu Actosa 45 mg jednom dnevno. Ispod su navedeni rezultati:
Oralni kontraceptivi: istodobna primjena Actosa (45 mg jednom dnevno) i oralnog kontracepcijskog sredstva (1 mg noretindrona plus 0,035 mg etinil estradiola jednom dnevno) tijekom 21 dana, rezultiralo je padom AUC etinilestradiola (0-24h) za 11% i 11-14% i Cmaksimum odnosno. Nije bilo značajnih promjena u AUC noretindrona (0-24h) i Cmaksimum. S obzirom na veliku varijabilnost farmakokinetike etinil estradiola, klinički značaj ovog nalaza nije poznat.
Feksofenadin HCl: Istodobna primjena Actosa 7 dana sa 60 mg feksofenadina oralno primijenjena dva puta dnevno nije dovela do značajnog utjecaja na farmakokinetiku pioglitazona. Actos nije imao značajnog utjecaja na farmakokinetiku feksofenadina.
Glipizid: Istodobna primjena Actosa i 5 mg glipizida primijenjena oralno jednom dnevno tijekom 7 dana nije promijenila farmakokinetiku glipizida u stanju stabilnosti.
Digoksin: Istodobna primjena Actosa s 0,25 mg digoksina koji se daje oralno jednom dnevno tijekom 7 dana nije promijenila farmakokinetiku digoksina u stanju stabilnosti.
Warfarin: Istodobna primjena Actosa tijekom 7 dana s varfarinom nije promijenila farmakokinetiku varfarina u stanju stabilnosti. Actos nema klinički značajan učinak na protrombinsko vrijeme kada se daje pacijentima koji su primali kroničnu terapiju varfarinom.
Metformin: Istodobna primjena jedne doze metformina (1000 mg) i Actosa nakon 7 dana Actosa nije promijenila farmakokinetiku pojedinačne doze metformina.
Midazolam: Primjena Actosa tijekom 15 dana, praćena jednom dozom od 7,5 mg midazolam sirupa, rezultirala je 26-postotnim smanjenjem midazolama Cmaksimum i AUC.
Ranitidin HCl: Istodobna primjena Actosa tijekom 7 dana s ranitidinom primijenjenim oralno dva puta dnevno tokom 4 ili 7 dana nije rezultirala značajnim učinkom na farmakokinetiku pioglitazona. Actos nije pokazao značajan utjecaj na farmakokinetiku ranitidina.
Nifedipin ER: Istodobna primjena Actosa tijekom 7 dana s 30 mg nifedipina ER oralno jedanput dnevno tijekom 4 dana muški i ženski dobrovoljci rezultirali su najmanje kvadratnim srednjim vrijednostima (90% CI) za nepromijenjeni nifedipin od 0,83 (0,73 - 0,95) za Cmaksimum i 0,88 (0,80 - 0,96) za AUC. S obzirom na veliku varijabilnost farmakokinetike nifedipina, klinički značaj ovog nalaza nije poznat.
Ketokonazol: istodobna primjena Actosa tijekom 7 dana s ketokonazolom 200 mg primijenjenim dva puta dnevno rezultiralo najmanje kvadratnim srednjim vrijednostima (90% CI) za nepromijenjeni pioglitazon od 1,14 (1,06 - 1,23) za Cmaksimum, 1,34 (1,26 - 1,41) za AUC i 1,87 (1,71 - 2,04) za Cmin.
Atorvastatin kalcij: Istodobna primjena Actosa tijekom 7 dana s atorvastatinskim kalcijem (LIPITOR®) 80 mg jednom dnevno rezultira najmanje kvadratnim srednjim vrijednostima (90% CI) za nepromijenjeni pioglitazon od 0,69 (0,57 - 0,85) za Cmaksimum0,76 (0,65 - 0,88) za AUC i 0,96 (0,87 - 1,05) za Cmin. Za nepromijenjeni atorvastatin najmanje kvadratne srednje vrijednosti (90% CI) bile su 0,77 (0,66 - 0,90) za Cmaksimum, 0,86 (0,78 - 0,94) za AUC i 0,92 (0,82 - 1,02) za Cmin.
Teofilin: Istodobna primjena Actosa tijekom 7 dana s teofilinom 400 mg primijenjenim dva puta dnevno nije rezultirala nikakvom promjenom u farmakokinetikama oba lijeka.
Citokrom P450: Vidi MJERE OPREZA
Gemfibrozil: Istodobna primjena gemfibrozila (oralno 600 mg dva puta dnevno), inhibitora CYP2C8, s pioglitazonom (30 mg oralno) u 10 zdravih dobrovoljaca prethodno liječenih 2 dana prije primjene gemfibrozila (oralno 600 mg dva puta dnevno) rezultiralo je da je izloženost pioglitazonu (AUC0-24) 226% izloženosti pioglitazonu u odsutnosti gemfibrozila (vidjeti MJERE OPREZA).
Rifampin: Istodobna primjena rifampina (peroralno 600 mg jednom dnevno), induktora CYP2C8 s pioglitazonom (30 mg oralno) u 10 zdravih dobrovoljci prethodno liječeni 5 dana prije rifampinom (peroralno 600 mg jednom dnevno) rezultirali su smanjenjem AUC pioglitazona za 54% (vidjeti MJERE OPREZA).
Farmakodinamika i klinički učinci
Kliničke studije pokazuju da Actos poboljšava osjetljivost na inzulin kod bolesnika otpornih na inzulin. Actos pojačava staničnu reakciju na inzulin, povećava odlaganje glukoze o inzulinu, poboljšava osjetljivost jetre na inzulin i poboljšava disfunkcionalnu homeostazu glukoze. U bolesnika s dijabetesom tipa 2, smanjena otpornost na inzulin proizvedena Actosom rezultira nižim koncentracijama glukoze u plazmi, nižim razinama inzulina u plazmi i nižim HbA1c vrijednosti. Na temelju rezultata otvorene studije proširenja, čini se da učinci snižavanja glukoze Actos traju najmanje godinu dana. U kontroliranim kliničkim ispitivanjima, Actos u kombinaciji sa sulfonilurejom, metforminom ili inzulinom imao je aditivan učinak na kontrolu glikemije.
Pacijenti s poremećajima lipida bili su uključeni u klinička ispitivanja s Actos-om. Sveukupno, bolesnici liječeni Actosom imali su prosječan pad triglicerida, srednji porast HDL kolesterola i bez konzistentnih srednjih promjena LDL-a i ukupnog kolesterola.
U 26-tjednoj, placebo kontroliranoj studiji raspona doza, prosječne razine triglicerida smanjene su u doziranim skupinama od 15 mg, 30 mg i 45 mg Actos u usporedbi s srednjim porastom placebo grupe. Srednja razina HDL povećala se u većoj mjeri u bolesnika liječenih Actosom nego u bolesnika liječenih placebom. Nije bilo konzistentnih razlika za LDL i ukupni kolesterol u bolesnika liječenih Actosom u usporedbi s placebom (tablica 1).
Tablica 1 Lipidi u 26-tjednoj placebo-kontroliranoj studiji monoterapije u kontroli doze
| Placebo | Actos 15 mg Jednom Dnevno |
Actos 30 mg Jednom Dnevno |
Actos 45 mg Jednom Dnevno |
|
| Trigliceridi (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Polazna vrijednost (srednja vrijednost) | 262.8 | 283.8 | 261.1 | 259.7 |
| Promjena postotka od početne (srednje) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL kolesterol (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Polazna vrijednost (srednja vrijednost) | 41.7 | 40.4 | 40.8 | 40.7 |
| Promjena postotka od početne (srednje) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL kolesterol (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Polazna vrijednost (srednja vrijednost) | 138.8 | 131.9 | 135.6 | 126.8 |
| Promjena postotka od početne (srednje) | 4.8% | 7.2% | 5.2% | 6.0% |
| Ukupni kolesterol (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Polazna vrijednost (srednja vrijednost) | 224.6 | 220.0 | 222.7 | 213.7 |
| Promjena postotka od početne (srednje) | 4.4% | 4.6% | 3.3% | 6.4% |
U dvije druge studije monoterapije (24 tjedna i 16 tjedana) i u kombiniranim studijama terapije sa sulfonilurejom (24 tjedna i 16 tjedana) i metformin (24 tjedna i 16 tjedana), rezultati su općenito bili u skladu s podacima iznad. U ispitivanjima koja su kontrolirana placebom, prosječne promjene koje su korigirale placebo od početne vrijednosti smanjile su se za 5% do 26% za trigliceride i povećale 6% do 13% za HDL u bolesnika liječenih Actosom. Sličan obrazac rezultata zabilježen je u 24-tjednim studijama kombinirane terapije Actos-om sa sulfonilurejom ili metforminom.
U studiji kombinirane terapije inzulinom (16 tjedana), smanjena je i srednja postotna promjena od placeba u odnosu na vrijednosti triglicerida za bolesnike liječene Actosom. Za skupinu doza od 15 mg uočena je placebo-korigirana srednja promjena od polazne vrijednosti LDL kolesterola od 7%. Primjećeni su slični rezultati kao i gore spomenuti za HDL i ukupni kolesterol. Sličan obrazac rezultata zabilježen je u 24-tjednoj kombiniranoj terapiji s Actosom s inzulinom.
Kliničke studije
monoterapija
U SAD-u su provedena tri randomizirana, dvostruko slijepa, placebo kontrolirana ispitivanja s trajanjem od 16 do 26 tjedana kako bi se procijenila uporaba Actosa kao monoterapije u bolesnika s dijabetesom tipa 2. Ove su studije ispitivale Actos u dozi do 45 mg ili placebo jednom dnevno u 865 bolesnika.
U 26-tjednoj studiji raspona doze, 408 bolesnika s dijabetesom tipa 2 randomizirano je da primaju 7,5 mg, 15 mg, 30 mg ili 45 mg Actosa ili placebo jednom dnevno. Terapija bilo kojim prethodnim antidijabetičkim lijekom prekinuta je 8 tjedana prije dvostruko slijepog razdoblja. Tretman s 15 mg, 30 mg i 45 mg Actosa doveo je do statistički značajnih poboljšanja HbA1c i glukoze u plazmi nakon posta (FPG) u krajnjoj točki u usporedbi s placebom (Slika 1, Tablica 2).
Na slici 1 prikazan je vremenski tijek promjena FPG-a i HbA1c za cjelokupnu populaciju ovog 26-tjednog ispitivanja.
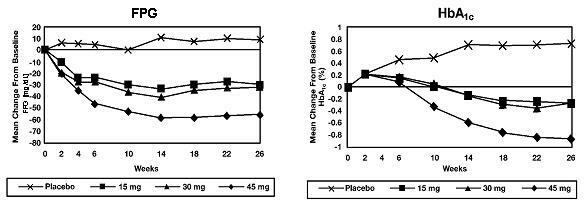
Tablica 2 prikazuje HbA1c i FPG vrijednosti za cjelokupnu populaciju ispitivanja.
Tablica 2 Glikemijski parametri u 26-tjednom placebo kontroliranom ispitivanju doze
| Placebo | Actos 15 mg Jednom Dnevno |
Actos 30 mg Jednom Dnevno |
Actos 45 mg Jednom Dnevno |
|
| UKUPNO STANOVNIŠTVO | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Polazna vrijednost (srednja vrijednost) | 10.4 | 10.2 | 10.2 | 10.3 |
| Promjena od početne (prilagođena srednja vrijednost)+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Razlika od placeba (prilagođena srednja vrijednost)+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Polazna vrijednost (srednja vrijednost) | 268 | 267 | 269 | 276 |
| Promjena od početne (prilagođena srednja vrijednost)+) | 9 | -30 | -32 | -56 |
| Razlika od placeba (prilagođena srednja vrijednost)+) | -39* | -41* | -65* | |
|
+ Prilagođeno za osnovni, združeni centar i združeni centar interakcijom liječenja * p â ‰ ¤ 0,050 vs. placebo |
Ispitna populacija obuhvaćala je bolesnike koji prethodno nisu liječeni antidijabetičkim lijekovima (nae; 31%) i pacijenti koji su primali antidijabetičke lijekove u vrijeme upisa u studiju (prethodno liječeni; 69%). Podaci za naps i prethodno liječene podskupine bolesnika prikazani su u tablici 3. Svi su pacijenti ušli u razdoblje odmora / iscrpljivanja od 8 tjedana prije dvostruko slijepog liječenja. Ovo razdoblje je povezano s malim promjenama HbA1c i FPG vrijednosti od probira do početne vrijednosti za na pacijente; međutim, za prethodno liječenu skupinu, ispiranje iz prethodnih antidijabetičkih lijekova rezultiralo je pogoršanjem kontrole glikemije i povećanjem HbA1c i FPG. Iako je kod većine bolesnika u prethodno liječenoj skupini smanjen HbA od početnog1c i FPG s Actosom, u mnogim se slučajevima do kraja studije vrijednosti nisu vratile na razine probira. Dizajn studije nije dozvolio procjenu pacijenata koji su izravno prešli na Actos s drugog antidijabetičkog sredstva.
Tablica 3 Glikemijski parametri u 26-tjednom placebo kontroliranom ispitivanju doze
| Placebo | Actos 15 mg Jednom Dnevno |
Actos 30 mg Jednom Dnevno |
Actos 45 mg Jednom Dnevno |
|
| Na ¡ve na terapiju HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (prosjek) | 9.3 | 10.0 | 9.5 | 9.8 |
| Polazna vrijednost (srednja vrijednost) | 9.0 | 9.9 | 9.3 | 10.0 |
| Promjena od početne (prilagođena srednja *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Razlika od placeba (prilagođeni prosjek *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (prosjek) | 223 | 245 | 239 | 239 |
| Polazna vrijednost (srednja vrijednost) | 229 | 251 | 225 | 235 |
| Promjena od početne (prilagođena srednja *) | 16 | -37 | -41 | -64 |
| Razlika od placeba (prilagođeni prosjek *) | -52 | -56 | -80 | |
| Prethodno obrađeno HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Screening (prosjek) | 9.3 | 9.0 | 9.1 | 9.0 |
| Polazna vrijednost (srednja vrijednost) | 10.9 | 10.4 | 10.4 | 10.6 |
| Promjena od početne (prilagođena srednja *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Razlika od placeba (prilagođeni prosjek *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Screening (prosjek) | 222 | 209 | 230 | 215 |
| Polazna vrijednost (srednja vrijednost) | 285 | 275 | 286 | 292 |
| Promjena od početne (prilagođena srednja *) | 4 | -32 | -27 | -55 |
| Razlika od placeba (prilagođeni prosjek *) | -36 | -31 | -59 | |
| * Prilagođeno za osnovnu liniju i sabrano središte |
U 24-tjednoj, placebo kontroliranoj studiji, 260 bolesnika s dijabetesom tipa 2 randomizirano je u jednu od dvije skupine s prisilnom titracijom Actos-om ili mock titration placebo skupinom. Terapija bilo kojim prethodnim antidijabetičkim sredstvom prekinuta je 6 tjedana prije dvostruko slijepog razdoblja. U jednoj skupini za liječenje Actosom pacijenti su primali početnu dozu od 7,5 mg jednom dnevno. Nakon četiri tjedna, doza je povećana na 15 mg jednom dnevno, a nakon sljedeća četiri tjedna doza je povećana na 30 mg jednom dnevno tijekom ostatka studije (16 tjedana). U drugoj skupini za liječenje Actosom bolesnici su primali početnu dozu od 15 mg jednom dnevno i titrirali su se na 30 mg jednom dnevno i 45 mg jednom dnevno na sličan način. Liječenje Actosom, kako je opisano, dovelo je do statistički značajnih poboljšanja HbA1c i FPG u krajnjoj točki u usporedbi s placebom (tablica 4).
Tablica 4 Glikemijski parametri u 24-tjednoj placebo kontroliranoj studiji prisilne titracije
| Placebo | Actos 30 mg+ Jednom dnevno |
Actos 45 mg+ Jednom dnevno |
|
| Ukupna populacija HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Polazna vrijednost (srednja vrijednost) | 10.8 | 10.3 | 10.8 |
| Promjena od početne (prilagođena srednja vrijednost)++) | 0.9 | -0.6 | -0.6 |
| Razlika od placeba (prilagođena srednja vrijednost)++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Polazna vrijednost (srednja vrijednost) | 279 | 268 | 281 |
| Promjena od početne (prilagođena srednja vrijednost)++) | 18 | -44 | -50 |
| Razlika od placeba (prilagođena srednja vrijednost)++) | -62* | -68* | |
|
+ Konačna doza u prisilnoj titraciji ++ Prilagođeno za osnovni, združeni centar i združeni centar interakcijom liječenja * p â ‰ ¤ 0,050 vs. placebo |
Za bolesnike koji prethodno nisu liječeni antidijabetičkim lijekovima (24%), srednje vrijednosti pri pregledu bile su 10,1% za HbA1c i 238 mg / dL za FPG. U početku srednja vrijednost HbA1c bio 10,2%, a prosječni FPG bio je 243 mg / dL. U usporedbi s placebom, liječenje Actos-om titrirano do konačne doze od 30 mg i 45 mg rezultiralo je smanjenjem prosječne HbA od početne1c od 2,3% i 2,6%, a prosječni FPG od 63 mg / dL, odnosno 95 mg / dL, respektivno. Za pacijente koji su prethodno liječeni antidijabetičkim lijekovima (76%), ovaj je lijek prekinuta pregledom. Srednje vrijednosti pri probiru bile su 9,4% za HbA1c i 216 mg / dL za FPG. U početku srednja vrijednost HbA1c bio je 10,7%, a prosječni FPG bio je 290 mg / dL. U usporedbi s placebom, liječenje Actos-om titrirano do konačne doze od 30 mg i 45 mg rezultiralo je smanjenjem prosječne HbA od početne1c od 1,3% i 1,4%, a prosječni FPG od 55 mg / dL, odnosno 60 mg / dL, respektivno. Za mnoge prethodno liječene bolesnike HbA1c i FPG se do kraja studije nisu vratili na razinu probira.
U 16-tjednoj studiji, 197 bolesnika s dijabetesom tipa 2 randomizirano je na liječenje 30 mg Actos-a ili placeba jednom dnevno. Terapija bilo kojim prethodnim antidijabetičkim sredstvom prekinuta je 6 tjedana prije dvostruko slijepog razdoblja. Tretman s 30 mg Actosa doveo je do statistički značajnih poboljšanja HbA1c i FPG u krajnjoj točki u usporedbi s placebom (tablica 5).
Tablica 5. Glikemijski parametri u 16-tjednoj placebo kontroliranoj studiji
| Placebo | Actos 30 mg Jednom dnevno |
|
| Ukupna populacija HbA1c (%) |
N = 93 | N = 100 |
| Polazna vrijednost (srednja vrijednost) | 10.3 | 10.5 |
| Promjena od početne (prilagođena srednja vrijednost)+) | 0.8 | -0.6 |
| Razlika od placeba (prilagođena srednja vrijednost)+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Polazna vrijednost (srednja vrijednost) | 270 | 273 |
| Promjena od početne (prilagođena srednja vrijednost)+) | 8 | -50 |
| Razlika od placeba (prilagođena srednja vrijednost)+) | -58* | |
|
+ Prilagođeno za osnovni, združeni centar i združeni centar interakcijom liječenja * p â ‰ ¤ 0,050 vs. placebo |
Za bolesnike koji prethodno nisu liječeni antidijabetičkim lijekovima (40%), srednje vrijednosti pri pregledu bile su 10,3% za HbA1c i 240 mg / dL za FPG. U početku srednja vrijednost HbA1c bio 10,4%, a prosječni FPG bio je 254 mg / dL. U usporedbi s placebom, liječenje Actosom 30 mg rezultiralo je smanjenjem početnog vrijednosti u srednjem HbA1c od 1,0%, a prosječni FPG od 62 mg / dL. Za pacijente koji su prethodno liječeni antidijabetičkim lijekovima (60%), ovaj je lijek prekinuta pregledom. Srednje vrijednosti pri probiru bile su 9,4% za HbA1c i 216 mg / dL za FPG. U početku srednja vrijednost HbA1c bio 10,6%, a prosječni FPG bio je 287 mg / dL. U usporedbi s placebom, liječenje Actosom 30 mg rezultiralo je smanjenjem početnog vrijednosti u srednjem HbA1c od 1,3% i prosječan FPG od 46 mg / dL. Za mnoge prethodno liječene bolesnike HbA1c i FPG se do kraja studije nisu vratili na razinu probira.
Kombinirana terapija
Tri 16-tjedna, randomizirana, dvostruko slijepa, placebo kontrolirana klinička ispitivanja i tri 24-tjedna, randomizirana, dvostruko slijepa, s dozom kontrolirana provedene su kliničke studije za procjenu učinaka Actosa na kontrolu glikemije u bolesnika s dijabetesom tipa 2 koji su bili neadekvatno kontrolirano (HbA)1c ‰ ¥ 8%) unatoč trenutnoj terapiji sulfonilurejom, metforminom ili inzulinom. Prethodno liječenje dijabetesa možda je bilo monoterapija ili kombinirana terapija.
Studije Actos Plus sulfoniluree
Provedena su dva klinička ispitivanja s Actos-om u kombinaciji sa sulfonilurejom. Obje studije obuhvaćale su bolesnike s dijabetesom tipa 2 na sulfonilureji, sami ili u kombinaciji s drugim antidijabetičkim sredstvom. Sva ostala antidijabetička sredstva povučena su prije početka ispitivanja. U prvoj studiji, 560 pacijenata je nasumično odabrano primati 15 mg ili 30 mg Actosa ili placeba jednom dnevno tijekom 16 tjedana, pored trenutnog režima sulfoniluree. U usporedbi s placebom u 16. tjednu, dodavanje Actosa sulfonilureji značajno je smanjilo prosječni HbA1c za 0,9% i 1,3%, a prosječni FPG za 39 mg / dL i 58 mg / dL za doze od 15 mg i 30 mg.
U drugom istraživanju, 702 bolesnika randomizirana su primati 30 mg ili 45 mg Actosa jednom dnevno tijekom 24 tjedna uz njihov trenutni režim sulfoniluree. Srednja smanjenja od početne vrijednosti u 24. tjednu HbA1c bili su 1,55% i 1,67% za doze od 30 mg i 45 mg. Srednja smanjenja od početne vrijednosti FPG-a bila su 51,5 mg / dL i 56,1 mg / dL.
Terapeutski učinak Actosa u kombinaciji sa sulfonilurejom primijećen je u bolesnika bez obzira na to jesu li pacijenti primali niske, srednje ili visoke doze sulfonilureje.
Studije metformina Actos Plus
Provedene su dvije kliničke studije s Actos-om u kombinaciji s metforminom. Obje studije su uključivale bolesnike s dijabetesom tipa 2 na metforminu, samostalno ili u kombinaciji s drugim antidijabetičkim sredstvom. Sva ostala antidijabetička sredstva povučena su prije početka ispitivanja. U prvoj studiji, 328 bolesnika randomizirano je da primaju 30 mg Actosa ili placebo jednom dnevno tijekom 16 tjedana, uz trenutni režim metformina. U usporedbi s placebom u 16. tjednu, dodavanje Actosa metforminu značajno je smanjilo prosječni HbA1c za 0,8% i smanjio je prosječni FPG za 38 mg / dL.
U drugom istraživanju, 827 bolesnika randomizirano je da primaju 30 mg ili 45 mg Actosa jednom dnevno tijekom 24 tjedna, uz trenutni režim metformina. Srednja smanjenja od početne vrijednosti u 24. tjednu HbA1c bili su 0,80% i 1,01% za doze od 30 mg i 45 mg, respektivno. Srednja smanjenja od početne vrijednosti FPG-a bila su 38,2 mg / dL i 50,7 mg / dL.
Terapeutski učinak Actosa u kombinaciji s metforminom opažen je u bolesnika bez obzira na to jesu li pacijenti primali niže ili veće doze metformina.
Studije inzulina Actos Plus
Provedena su dva klinička ispitivanja s Actos-om u kombinaciji s inzulinom. Obje studije uključuju bolesnike s dijabetesom tipa 2 na inzulin, sami ili u kombinaciji s drugim antidijabetičkim sredstvom. Sva ostala antidijabetička sredstva povučena su prije početka ispitivanja. U prvom istraživanju randomizirano je 566 pacijenata koji su primali medijan od 60,5 jedinica dnevno inzulina primati 15 mg ili 30 mg Actosa ili placeba jednom dnevno tijekom 16 tjedana, pored inzulina režim. U usporedbi s placebom u 16. tjednu, dodavanje Actosa inzulinu značajno je smanjilo oba HbA1c za 0,7% i 1,0%, a FPG za 35 mg / dL i 49 mg / dL za dozu od 15 mg i 30 mg, respektivno.
U drugom istraživanju, 690 pacijenata koji su primali medijan od 60,0 jedinica inzulina na dan primili su 30 mg ili 45 mg Actosa jednom dnevno tijekom 24 tjedna uz trenutni režim inzulina. Srednja smanjenja od početne vrijednosti u 24. tjednu HbA1c bilo je 1,17% i 1,46% za doze od 30 mg i 45 mg, respektivno. Srednja smanjenja od početne vrijednosti FPG bila su 31,9 mg / dL i 45,8 mg / dL. Poboljšana kontrola glikemije praćena je srednjim smanjenjem u odnosu na početnu vrijednost doze inzulina od 6,0% i 9,4% dnevno za dozu od 30 mg i 45 mg.
Terapeutski učinak Actosa u kombinaciji s inzulinom zabilježen je u bolesnika bez obzira na to jesu li pacijenti primali niže ili veće doze inzulina.
vrh
Indikacije i upotreba
Actos je indiciran kao dodatak prehrani i vježbanju radi poboljšanja kontrole glikemije u odraslih s dijabetesom melitusa tipa 2.
vrh
kontraindikacije
Iniciranje Actos-a u bolesnika s utvrđenom srčanom insuficijencijom New Yorka (NYHA) klase III ili IV je kontraindicirano (vidjeti OKVIRNO UPOZORENJE).
Actos je kontraindiciran u bolesnika s poznatom preosjetljivošću na ovaj proizvod ili bilo koju od njegovih komponenti.
vrh
Upozorenja
Zatajivanje srca i ostali kardiološki učinci
Actos, poput ostalih tiazolidindiona, može uzrokovati zadržavanje tekućine ako se koristi sam ili u kombinaciji s drugim antidijabetičkim lijekovima, uključujući inzulin. Zadržavanje tekućine može dovesti do ili pogoršati zatajenje srca. Bolesnike treba promatrati zbog znakova i simptoma zatajenja srca. Ako se ovi znakovi i simptomi razviju, zatajenje srca treba upravljati prema trenutnim standardima skrbi. Nadalje, mora se razmotriti prekid ili smanjenje doze lijeka Actos (vidjeti OKVIRNO UPOZORENJE). Bolesnici s srčanim statusom NYHA klase III i IV nisu proučavani tijekom kliničkih ispitivanja prije odobrenja, a Actos se ne preporučuje u tih bolesnika (vidjeti OKVIRNO UPOZORENJE i KONTRAINDIKACIJE).
U jednom 16-tjednom američkom dvostruko slijepom, placebo kontroliranom kliničkom ispitivanju u koje je bilo uključeno 566 pacijenata s tipom 2 dijabetes, Actos u dozama od 15 mg i 30 mg u kombinaciji s inzulinom uspoređivan je s inzulinskom terapijom sama. Ovo ispitivanje je uključivalo bolesnike s dugogodišnjom dijabetesom i velikom učestalošću postojećih zdravstvenih stanja, kako slijedi: arterijska hipertenzija (57,2%), periferna neuropatija (22,6%), koronarna bolest srca (19,6%), retinopatija (13,1%), miokardijal infarkt (8,8%), vaskularna bolest (6,4%), angina pektoris (4,4%), moždani udar i / ili prolazni ishemijski napad (4,1%), i kongestivni zatajenje srca (2,3%).
U ovoj studiji, dva od 191 pacijenta koji su primali 15 mg Actos plus inzulin (1,1%) i dva od 188 pacijenata koji su primali 30 mg Actos plus inzulin (1,1%) razvio je kongestivno zatajenje srca u usporedbi s niti jednim od 187 pacijenata koji su bili sami na terapiji inzulinom. Sva četvorica ovih bolesnika imala su raniju povijest kardiovaskularnih stanja, uključujući koronarnu arterijsku bolest, prethodne CABG postupke i infarkt miokarda. U 24-tjednoj studiji kontroliranoj od doze u kojoj je Actos istodobno primijenjen inzulin, 0,3% bolesnika (1/345) na 30 mg i 0,9% (3/345) pacijenata na 45 mg prijavilo je CHF kao ozbiljan štetni događaj ,
Analiza podataka iz ovih studija nije utvrdila specifične čimbenike koji predviđaju povećani rizik od kongestivnog zatajenja srca na kombiniranoj terapiji inzulinom.
Dijabetes tipa 2 i kongestivno zatajenje srca (sistolička disfunkcija)
Provedena je 24-tjedna ispitivanja ispitivanja sigurnosti kako bi se usporedio Actos (n = 262) s gliburidom (n = 256) u nekontroliranih bolesnika s dijabetesom (prosječna vrijednost HbA1c 8,8% u početnoj fazi) sa zatajenjem srca NYHA klase II i III i frakcijom izbacivanja manjom od 40% (srednja vrijednost EF 30% na početku). Tijekom studije prijavljeno je prekonoćno hospitaliziranje zbog kongestivnog zatajenja srca u 9,9% pacijenti na Actosu u usporedbi s 4,7% bolesnika koji su bili na gliburidu s razlikom u liječenju od 6 tjedni. Ovaj štetni događaj povezan s Actosom bio je izraženiji u bolesnika koji su inzulin koristili u početnoj fazi i u bolesnika starijih od 64 godine. Nije opažena razlika u smrtnosti od kardiovaskularnog sustava između skupina liječenja.
Actos treba započeti s najnižom odobrenom dozom ako je propisana bolesnicima s dijabetesom tipa 2 i sistoličkim zatajenjem srca (klasa II od NYHA). Ako je potrebno naknadno povećavanje doze, dozu treba povećavati postupno tek nakon nekoliko mjeseci liječenja uz pažljivo praćenje debljanja, edema ili znakova i simptoma CHF pogoršanje.
Prospektivno kliničko ispitivanje pioglitazona u makrovaskularnim događajima (proaktivno)
U PROAktivu, 5238 bolesnika s dijabetesom tipa 2 i ranijom poviješću makrovaskularne bolesti liječeno je Actosom (n = 2605), titrirano do 45 mg jednom dnevno, ili placebom (n = 2633) (vidjeti NEPOVOLJNE REAKCIJE). Postotak bolesnika koji su imali ozbiljan srčani zastoj veći je za bolesnike liječene Actosom (5,7%, n = 149) nego za bolesnike liječene placebom (4,1%, n = 108). Incidencija smrti nakon izvještaja o ozbiljnom zatajenju srca bila je 1,5% (n = 40) u bolesnika liječenih Actosom i 1,4% (n = 37) u bolesnika liječenih placebom. U bolesnika liječenih režimom koji sadrži inzulin na početku, učestalost ozbiljnog zatajenja srca bila je 6,3% (n = 54/864) s Actosom i 5,2% (n = 47/896) s placebom. Za one bolesnike koji su u početku liječeni režimom koji sadrži sulfonilureju, učestalost ozbiljnog zatajenja srca bila je 5,8% (n = 94/1624) s Actosom i 4,4% (n = 71/1626) s placebom.
vrh
Mjere opreza
Općenito
Actos pokazuje svoje antihiperglikemijsko djelovanje samo u prisutnosti inzulina. Stoga se Actos ne smije primjenjivati u bolesnika s dijabetesom tipa 1 niti za liječenje dijabetičke ketoacidoze.
Hipoglikemija: Pacijenti koji primaju Actos u kombinaciji s inzulinom ili oralnim hipoglikemijskim sredstvima mogu biti u opasnosti od hipoglikemije, pa će možda biti potrebno smanjenje doze istodobnog agensa.
Kardiovaskularni: U američkim placebo kontroliranim kliničkim ispitivanjima koja su isključila bolesnike s New York Heart Association (NYHA) klase III i IV kardiološkog statusa, učestalost ozbiljni srčani štetni događaji povezani sa ekspanzijom volumena nisu povećani u bolesnika liječenih Actosima kao monoterapija ili u kombinaciji sa sulfonilureama ili metforminom vs bolesnika koji su liječeni placebom. U ispitivanjima kombinacije inzulina, mali je broj pacijenata s poviješću već postojao srčana bolest razvila kongestivno zatajenje srca kada se liječi Actosom u kombinaciji s inzulinom (vidjeti UPOZORENJA). U ovim kliničkim ispitivanjima Actos nisu proučavani srčani status NYHA klase III i IV. Actos nije indiciran u bolesnika sa srčanim statusom klase III ili IV od NYHA.
U iskustvu postmarketinškog lijeka s Actosom, zabilježeni su slučajevi kongestivnog zatajenja srca kod pacijenata sa i bez ranije poznatih srčanih bolesti.
Edemi: Actos treba primjenjivati s oprezom u bolesnika s edemom. U svim američkim kliničkim ispitivanjima prijavljen je edem češće u bolesnika liječenih Actosom nego u bolesnika liječenih placebom i čini se da je to povezano s dozom (vidjeti NEPOVOLJNE REAKCIJE). U iskustvu postmarketinške prodaje primljena su izvješća o pokretanju ili pogoršanju edema. Budući da tiazolidindioni, uključujući Actos, mogu uzrokovati zadržavanje tekućine, što može pogoršati ili dovesti do kongestivnog zatajenja srca, Actos treba primjenjivati s oprezom u bolesnika s rizikom za zatajenje srca. Bolesnike treba nadzirati zbog znakova i simptoma zatajenja srca (vidi OKVIRNO UPOZORENJE, UPOZORENJA, i MJERE OPREZA).
Povećanje tjelesne težine: Dobivanje tjelesne težine uočeno je samim Actosom i u kombinaciji s drugim hipoglikemijskim agensima (tablica 6). Mehanizam debljanja nije jasan, ali vjerojatno uključuje kombinaciju zadržavanja tekućine i nakupljanja masti.
Tablica 6 Promjene težine (kg) od osnovne vrijednosti tijekom dvostruko slijepih kliničkih ispitivanja s Actos-om
| Kontrolna skupina (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| srednja (25th/75th postotak) |
srednja (25th/75th postotak) |
srednja (25th/75th postotak) |
srednja (25th/75th postotak) |
||
| monoterapija | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinirana terapija | sulfonilurejom | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| metformin | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| insulin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Napomena: Probno trajanje od 16 do 26 tjedana |
Ovulacija: Terapija Actosom, kao i drugim tiazolidindionima, može rezultirati ovulacijom kod nekih premenopauzalnih anovulacijskih žena. Kao rezultat, ove pacijentice mogu imati povećan rizik za trudnoću tijekom uzimanja lijeka Actos. Zbog toga treba preporučiti odgovarajuću kontracepciju kod žena u predmenopauzi. Ovaj mogući učinak nije ispitan u kliničkim studijama pa učestalost ove pojave nije poznata.
Hematološki: Actos može uzrokovati smanjenje hemoglobina i hematokrita. U svim kliničkim studijama, vrijednosti hemoglobina smanjile su se za 2% do 4% u bolesnika liječenih Actos-om. Te su se promjene uglavnom događale unutar prvih 4 do 12 tjedana terapije i nakon toga ostale relativno konstantne. Te promjene mogu biti povezane s povećanim volumenom plazme i rijetko su povezane s bilo kojim značajnim hematološkim kliničkim učincima (vidjeti NEPOVOLJNE REAKCIJE, Povijesti laboratorija).
Jetreni efekti: U kliničkim studijama prije odobrenja širom svijeta, više od 4500 ispitanika liječeno je lijekom Actos. U američkim kliničkim istraživanjima, preko 4700 pacijenata s dijabetesom tipa 2 primilo je Actos. U kliničkim ispitivanjima nije bilo dokaza o hepatotoksičnosti uzrokovanoj lijekovima ili povećanju razine ALT.
Tijekom kliničkih ispitivanja liječenja u SAD-u prije odobrenja, ukupno je bilo 4 od 1526 (0,26%) pacijenata liječeni Actosom, a 2 od 793 (0,25%) placebo liječenih bolesnika imale su ALT vrijednosti ‰ times 3 puta više od gornje granice normalna. Povišice ALT u bolesnika liječenih Actosom bile su reverzibilne i nisu bile jasno povezane s terapijom lijekom Actos.
U postmarketinškom iskustvu s Actosom primljena su izvješća o hepatitisu i porastu jetrenih enzima do 3 ili više puta više od gornje granice normale. Vrlo rijetko su ta izvješća uključivala zatajenje jetre sa i bez smrtnog ishoda, iako uzročnost nije utvrđena.
U očekivanju dostupnosti rezultata dodatnih velikih, dugoročno kontroliranih kliničkih ispitivanja i dodatnih nakon podataka o sigurnosti nakon stavljanja na tržište, preporučuje se da pacijenti liječeni Actosom prolaze periodično nadziranje jetre enzimi.
Razine ALT (alanin aminotransferaze) u serumu trebaju se procijeniti prije početka terapije s Actos u svih bolesnika i periodično nakon toga, prema kliničkoj prosudbi zdravstvene zaštite profesionalno. Testove jetrenih testova treba dobiti i pacijentima ako se pojave simptomi koji ukazuju na poremećaj jetre, npr. Mučninu, povraćanje, bol u trbuhu, umor, anoreksiju ili taman urin. Odluka o tome hoće li pacijent nastaviti na terapiji lijekom Actos trebala bi se voditi prema kliničkoj prosudbi do laboratorijske procjene. Ako se primijeti žutica, liječenje lijekovima treba prekinuti.
Terapija Actosom ne smije se započeti ako pacijent pokaže kliničke dokaze aktivne bolesti jetre ili razina ALT-a prijeđe 2,5 puta više od gornje granice normale. Bolesnici s blago povišenim jetrenim enzimima (razina ALT-a od 1 do 2,5 puta veća od gornje granice normale) na treba odrediti početnu vrijednost ili bilo koje vrijeme tijekom terapije Actosom kako bi se utvrdio uzrok jetrenih enzima nadmorska visina. Pokretanje ili nastavak terapije lijekom Actos u bolesnika s blago povišenim jetrenim enzimima treba nastaviti s oprezom i uključuju odgovarajuće kliničko praćenje koje može uključivati učestalije jetrene enzime praćenja. Ako su razine transaminaza u serumu povećane (ALT> 2,5 puta više od gornje granice normale), jetra funkcionalne testove treba ocjenjivati češće dok se razine ne vrate u normalu ili prije obrade vrijednosti. Ako razina ALT-a prelazi 3 puta gornju granicu normale, test treba ponoviti što je prije moguće. Ako razina ALT ostane> 3 puta veća od gornje granice normale ili ako je pacijent žutica, terapiju Actosom treba prekinuti.
Makularni edem: Zabilježen je makularni edem u postmarketinškom iskustvu kod dijabetičara koji su uzimali pioglitazon ili neki drugi tiazolidindion. Neki su pacijenti imali zamagljen vid ili smanjenu oštrinu vida, ali čini se da su neki pacijenti dijagnosticirani na rutinskom oftalmološkom pregledu. Neki su pacijenti imali periferni edem u vrijeme kada je dijagnosticiran makularni edem. Neki su pacijenti imali poboljšanje makularnog edema nakon prestanka uzimanja tiazolidindiona. Nije poznato postoji li ili ne uzročno veza između pioglitazona i makularnog edema. Pacijenti s dijabetesom trebali bi imati redovne preglede oka kod oftalmologa prema standardima skrbi Američke američke udruge za dijabetes. Uz to, svaki dijabetičar koji prijavi bilo koju vrstu vizualnog simptoma treba odmah uputiti oftalmologu, bez obzira na pacijentove lijekove ili druge fizičke nalaze (vidi NEPOVOLJNE REAKCIJE).
Prijelomi: U randomiziranom ispitivanju (PROaktivno) u bolesnika s dijabetesom tipa 2 (prosječno trajanje od dijabetes 9,5 godina), zabilježena je povećana učestalost preloma kostiju kod žena koje uzimaju pioglitazon. Tijekom prosječnog praćenja od 34,5 mjeseci, učestalost frakture kostiju kod žena bila je 5,1% (44/870) za pioglitazon, u usporedbi s 2,5% (23/905) za placebo. Ova je razlika primijećena nakon prve godine liječenja i ostala je tijekom ispitivanja. Većina prijeloma uočenih kod pacijentica bili su neververtebralni prijelomi, uključujući donji i distalni gornji ud. Nije opaženo povećanje stope loma kod muškaraca liječenih pioglitazonom 1,7% (30/1735) nasuprot placebu 2,1% (37/1728). Rizik od prijeloma treba uzeti u obzir u liječenju pacijenata, osobito žena koje se liječe pioglitazon i pozornost treba posvetiti procjeni i održavanju zdravlja kostiju prema trenutnim standardima od njege.
Makrovaskularni ishodi: Nijedna klinička studija nije utvrdila konačne dokaze o smanjenju makrovaskularnog rizika s Actosom ili bilo kojim drugim lijekom protiv dijabetesa.
Laboratorijska ispitivanja
FPG i HbA1c mjerenja treba provoditi periodično radi praćenja glikemijske kontrole i terapijskog odgovora na Actos.
Preporučuje se praćenje jetrenih enzima prije početka terapije lijekom Actos kod svih bolesnika i periodično nakon toga, prema kliničkoj presudi zdravstvenog radnika (vidjeti MJERE OPREZA, Opće, jetreni efekti i NEPOVOLJNE REAKCIJE, Razine transaminaza u serumu).
Informacije za pacijente
Važno je uputiti pacijente da se pridržavaju dijetalnih uputa i da redovito testiraju glukozu u krvi i glikozilirani hemoglobin. Tijekom razdoblja stresa poput vrućice, traume, infekcije ili operacije, potrebe za lijekovima mogu se promijeniti i bolesnike treba podsjetiti da odmah potraže medicinski savjet.
Pacijenti kod kojih dolazi do neuobičajeno brzog povećanja težine ili edema ili kod kojih se javlja nedostatak daha ili drugih simptoma zatajenja srca dok na Actosu trebaju odmah prijaviti ove simptome liječnik.
Pacijentima treba reći da će se krvni testovi za rad jetre obaviti prije početka terapije i periodično nakon toga, prema kliničkoj presudi zdravstvenog radnika. Pacijentima treba reći da odmah potraže medicinski savjet zbog neobjašnjive mučnine, povraćanja, bolova u trbuhu, umora, anoreksije ili tamnog urina.
Pacijentima treba reći da uzimaju Actos jednom dnevno. Actos se može uzimati sa ili bez obroka. Ako se doza propusti jedan dan, doza se ne smije udvostručiti sljedeći dan.
Kada se koristi kombinirana terapija inzulinom ili oralnim hipoglikemijskim sredstvima, rizici hipoglikemije, njeni simptomi i liječenje i uvjete koji predisponiraju njegov razvoj treba objasniti pacijentima i njihovoj obitelji članovi.
Terapija Actosom, kao i drugim tiazolidindionima, može rezultirati ovulacijom kod nekih premenopauzalnih anovulacijskih žena. Kao rezultat, ove pacijentice mogu imati povećan rizik za trudnoću tijekom uzimanja lijeka Actos. Zbog toga treba preporučiti odgovarajuću kontracepciju kod žena u predmenopauzi. Ovaj mogući učinak nije ispitan u kliničkim studijama pa učestalost ove pojave nije poznata.
Interakcije s lijekovima
Studije interakcije lijekova i lijekova in vivo sugerirale su da pioglitazon može biti slab induktor supstrata CYP 450 izoform 3A4 (vidjeti KLINIČKA FARMAKOLOGIJA, Metabolizam i Interakcije lijekova i droga).
Enzimski inhibitor CYP2C8 (kao što je gemfibrozil) može značajno povećati AUC od pioglitazon i enzimski induktor CYP2C8 (poput rifampina) mogu značajno smanjiti AUC od pioglitazon. Stoga, ako se započne ili zaustavi inhibitor ili induktor CYP2C8 tijekom liječenja pioglitazonom, možda će biti potrebne promjene u liječenju dijabetesa na temelju kliničkog odgovora (vidjeti KLINIČKA FARMAKOLOGIJA, Interakcije lijekova i droga).
Kancerogeneza, mutageneza, oštećenje plodnosti
Provedeno je dvogodišnje istraživanje kancerogenosti na muškim i ženskim štakorima u oralnim dozama do 63 mg / kg (otprilike 14 puta od maksimalne preporučene oralne doze od 45 mg na temelju mg / m2). Tumori izazvani lijekovima nisu primijećeni ni u jednom organu, osim mokraćnog mjehura. Uočene su dobroćudne i / ili zloćudne neoplazme tranzicijskih stanica kod mužjaka štakora od 4 mg / kg / dan i više (približno jednaka najvećoj preporučenoj oralnoj dozi za ljude na osnovi mg / m2). Provedeno je dvogodišnje ispitivanje kancerogenosti kod muških i ženskih miševa u oralnim dozama do 100 mg / kg / dan (otprilike 11 puta najveće preporučene oralne doze za ljude na osnovi mg / m2). Nisu primijećeni tumori uzrokovani lijekovima niti u jednom organu.
Tijekom prospektivne procjene mokraćne citologije koja je uključivala više od 1800 pacijenata koji su primali Actos u kliničkim ispitivanjima u trajanju do jedne godine, nisu utvrđeni novi slučajevi tumora mokraćnog mjehura. U dvije trogodišnje studije u kojima je pioglitazon uspoređivan s placebom ili gliburidom, bilo ih je 16/3656 (0,44%) izvješća o karcinomu mokraćnog mjehura u bolesnika koji uzimaju pioglitazon u usporedbi s 5/3679 (0,14%) u bolesnika koji ne uzimaju pioglitazon. Nakon što su isključeni pacijenti kod kojih je u vrijeme dijagnoze raka mokraćnog mjehura izloženost ispitivanom lijeku bila manja od jedne godine, bilo je šest (0,16%) slučajeva pioglitazona i dva (0,05%) placeba.
Pioglitazon HCl nije bio mutagen u bateriji genetskih toksikoloških ispitivanja, uključujući Amesov bakterijski test, gad sisava stanica prema naprijed mutacijski test (CHO / HPRT i AS52 / XPRT), in vitro ispitivanje citogenetike pomoću CHL stanica, neplanirani test sinteze DNA i in vivo mikronukleus Test.
Nisu primijećeni štetni učinci na plodnost kod muških i ženskih štakora pri oralnim dozama do 40 mg / kg pioglitazona HCl dnevno prije i tijekom parenja i tijekom trudnoće (otprilike 9 puta maksimalna preporučena oralna doza za ljude na temelju mg / m2).
Toksikologija životinja
Uočeno je povećanje srca kod miševa (100 mg / kg), štakora (4 mg / kg i više) i pasa (3 mg / kg) liječenih oralno pioglitazon HCl (otprilike 11, 1 i 2 puta najveća preporučena oralna doza za ljude za miševe, štakore i pse, na osnovi mg / m2). U jednogodišnjem istraživanju štakora, rana smrt povezana s lijekovima zbog očite srčane disfunkcije dogodila se u oralna doza od 160 mg / kg / dan (otprilike 35 puta veća od preporučene ljudske oralne doze na temelju mg / m2). Povećanje srca zabilježeno je u 13-tjednom ispitivanju na majmunima kod oralnih doza od 8,9 mg / kg i više (otprilike 4 puta od maksimalne preporučene oralne doze za ljude na temelju mg / m2), ali ne u 52-tjednom ispitivanju kod oralnih doza do 32 mg / kg (otprilike 13 puta najveće preporučene oralne doze za ljude na temelju mg / m2).
Trudnoća
Trudnoća kategorija C. Pioglitazon nije bio teratogen kod štakora kod oralnih doza do 80 mg / kg ili kod zečeva do 160 mg / kg tijekom organogeneze (otprilike 17 i 40 puta veća od preporučene ljudske oralne doze na mg / m2odnosno). Zakašnjelo rađanje i embriotoksičnost (o čemu svjedoče povećani gubici postimplantacije, odgođeni razvoj i smanjena težina ploda) opaženi su na štakorima kod oralnih doza od 40 mg / kg / dan i više (otprilike 10 puta najveće preporučene oralne doze za ljude na temelju mg / m2). Nije zabilježena funkcionalna ili bihevioralna toksičnost kod potomstva štakora. Kod kunića uočena je embriotoksičnost kod oralne doze od 160 mg / kg (otprilike 40 puta najveće preporučene oralne doze za ljude na temelju mg / m2). Odgođen postnatalni razvoj, pripisan smanjenoj tjelesnoj težini, opažen je kod potomstva štakora pri oralnim dozama od 10 mg / kg i više tijekom razdoblja kasne gestacije i dojenja (otprilike 2 puta najveće preporučene oralne doze za ljude na temelju mg / m2).
Ne postoje odgovarajuća i dobro kontrolirana ispitivanja na trudnicama. Actos se treba koristiti tijekom trudnoće samo ako potencijalna korist opravdava potencijalni rizik za plod.
Budući da trenutne informacije snažno sugeriraju da su nenormalne razine glukoze u krvi tijekom trudnoće povezane i s većom učestalošću urođenih anomalija, Kako povećani neonatalni morbiditet i smrtnost, većina stručnjaka preporučuje primjenu inzulina tijekom trudnoće kako bi se održavala razina glukoze u krvi što bliža normalnoj moguće.
Negovateljice
Pioglitazon se izlučuje u mlijeku štakora. Nije poznato da li se Actos izlučuje u majčinom mlijeku. Budući da se mnogi lijekovi izlučuju u majčino mlijeko, Actos se ne smije davati ženi koja doji dijete.
Dječja upotreba
Sigurnost i djelotvornost lijeka Actos u pedijatrijskih bolesnika nisu utvrđene.
Upotreba starijih osoba
Otprilike 500 bolesnika u placebo kontroliranim kliničkim ispitivanjima lijeka Actos bilo je 65 i više godina. Nisu primijećene značajne razlike u učinkovitosti i sigurnosti između ovih i mlađih bolesnika.
vrh
Nuspojave
Preko 8500 pacijenata s dijabetesom tipa 2 liječeno je Actosom u randomiziranim, dvostruko slijepim, kontroliranim kliničkim ispitivanjima. To uključuje 2605 visoko rizičnih bolesnika s dijabetesom tipa 2 liječenih Actosom iz kliničkog ispitivanja PROactive. Preko 6000 pacijenata liječeno je 6 mjeseci ili duže, a preko 4500 pacijenata jednu godinu ili duže. Preko 3000 pacijenata je primilo Actos najmanje 2 godine.
Ukupna učestalost i vrste nuspojava prijavljeni u placebo kontroliranim kliničkim ispitivanjima Actos monoterapije u dozama od 7,5 mg, 15 mg, 30 mg ili 45 mg jednom dnevno prikazani su u tablici 7.
Tablica 7 Klinička ispitivanja placebom kontrolirane monoterapije Actosom: nuspojave prijavljene u učestalosti ‰ ¥ 5% pacijenata liječenih actosom
| (% pacijenata) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Infekcija gornjeg dišnog trakta | 8.5 | 13.2 |
| Glavobolja | 6.9 | 9.1 |
| upala sinusa | 4.6 | 6.3 |
| Mialgija | 2.7 | 5.4 |
| Poremećaj zuba | 2.3 | 5.3 |
| Dijabetes melitus pogoršan | 8.1 | 5.1 |
| upala grla | 0.8 | 5.1 |
Za većinu kliničkih nuspojava incidencija je bila slična za skupine liječene monoterapijom Actos i one liječene u kombinaciji sa sulfonilureama, metforminom i inzulinom. Povećao se pojava edema kod bolesnika liječenih Actosom i inzulinom u usporedbi sa samim inzulinom.
U 16-tjednom, placebo kontroliranom ispitivanju Actos plus inzulina (n = 379), 10 bolesnika liječenih Actos plus inzulina razvila dispneja i također, u nekom trenutku tijekom terapije, razvila ili promjenu težine ili edem. Sedam od tih 10 pacijenata dobilo je diuretike za liječenje ovih simptoma. To nije prijavljeno u skupini s insulinom plus placebom.
Učestalost povlačenja iz placebo kontroliranih kliničkih ispitivanja zbog neželjenog događaja koji nije hiperglikemija bila je slična za bolesnike liječene placebom (2,8%) ili Actos (3,3%).
U ispitivanjima kombinirane terapije kombiniranom sulfonilureom ili inzulinom, prijavljena je blaga do umjerena hipoglikemija, za koju se čini da je povezana s dozom (vidjeti MJERE OPREZA, Općenito, Hipoglikemija i DOZIRANJE I UPRAVLJANJE, Kombinirana terapija).
U američkim dvostruko slijepim istraživanjima zabilježena je anemija kod 2% bolesnika liječenih Actos plus sulfonilurea, metformin ili inzulin (vidjeti MJERE OPREZA, Općenito, Hematološki).
U ispitivanjima monoterapije zabilježen je edem za 4,8% (s dozama od 7,5 mg do 45 mg) bolesnika liječenih Actosom u usporedbi s 1,2% bolesnika liječenih placebom. U studijama kombinirane terapije prijavljen je edem za 7,2% bolesnika liječenih Actos-om i sulfonilureama u usporedbi s 2,1% bolesnika koji su bili na samo sulfonilureji. U studijama kombinirane terapije metforminom prijavljen je edem u 6,0% bolesnika na kombiniranoj terapiji u usporedbi s 2,5% bolesnika koji su uzimali samo metformin. U studijama kombinirane terapije inzulinom zabilježen je edem kod 15,3% bolesnika na kombiniranoj terapiji u usporedbi sa 7,0% bolesnika koji su sami uzimali inzulin. Većina tih događaja smatrana je blagim ili umjerenim intenzitetom (vidi MJERE OPREZA, Općenito, Edema).
U jednom 16-tjednom kliničkom ispitivanju inzulina plus Actos kombinirane terapije, više pacijenata razvilo je kongestivno zatajenje srca na kombiniranoj terapiji (1,1%) u usporedbi s nijednim samo na inzulinu (vidjeti UPOZORENJA, Zatajivanje srca i ostali kardiološki efekti).
Prospektivno kliničko ispitivanje pioglitazona u makrovaskularnim događajima (proaktivno)
U PROAktivu je bilo 5238 bolesnika s dijabetesom tipa 2 i ranijom poviješću makrovaskularne bolesti liječeni Actosom (n = 2605), s titriranjem sila do 45 mg dnevno ili placebom (n = 2633) uz standardni od njege. Gotovo svi ispitanici (95%) primali su kardiovaskularne lijekove (beta blokatori, ACE inhibitori, ARB, blokatori kalcijevih kanala, nitrati, diuretici, aspirin, statini, fibrati). Pacijenti su imali prosječnu dob od 61,8 godina, prosječno trajanje dijabetesa 9,5 godina, a prosječni HbA1c 8,1%. Prosječno trajanje praćenja bilo je 34,5 mjeseci. Glavni cilj ovog ispitivanja bio je ispitati učinak Actosa na smrtnost i makrovaskularni morbiditet u bolesnika sa šećernom bolešću tipa 2 koji su bili pod visokim rizikom makrovaskularni događaji. Primarna varijabla učinkovitosti bila je vrijeme do prve pojave bilo kojeg događaja u kardiovaskularnoj kompozitnoj krajnjoj točki (vidjeti tablicu 8 dolje). Iako nije bilo statistički značajne razlike između Actos-a i placeba za 3-godišnju incidenciju prvi događaj u ovom sastavu nije zabilježen porast smrtnosti niti ukupno makrovaskularnih događaja sa Actos.
Tablica 8 Broj prvih i ukupnih događaja za svaku komponentu unutar kardiovaskularne krajnje točke kompozita
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Kardiovaskularni događaji | Prvi događaji (N) |
Ukupno događaja (N) |
Prvi događaji (N) |
Ukupno događaja (N) |
| Bilo koji događaj | 572 | 900 | 514 | 803 |
| Smrtnost od svih uzroka | 122 | 186 | 110 | 177 |
| Nefatalni MI | 118 | 157 | 105 | 131 |
| udar | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Srčana intervencija | 101 | 240 | 101 | 195 |
| Velika amputacija nogu | 15 | 28 | 9 | 28 |
| Revaskularizacija nogu | 57 | 92 | 71 | 115 |
Primljena su i izvješća o naknadnom stavljanju na tržište ili novi pogoršani dijabetički edem makule sa smanjenom oštrinom vida (vidi MJERE OPREZA, Općenito, Makularni edem).
Abnormalnosti u laboratoriju
Hematološki: Actos može uzrokovati smanjenje hemoglobina i hematokrita. Čini se da je pad hemoglobina i hematokrita s Actosom povezan s dozom. U svim kliničkim studijama, vrijednosti hemoglobina smanjile su se za 2% do 4% u bolesnika liječenih Actos-om. Te su se promjene uglavnom događale unutar prvih 4 do 12 tjedana terapije i nakon toga ostale relativno stabilne. Te promjene mogu biti povezane s povećanim volumenom plazme povezane s terapijom Actosom i rijetko su povezane sa bilo kojim značajnim hematološkim kliničkim učincima.
Razine transaminaza u serumu: Tijekom svih kliničkih ispitivanja u SAD-u, 14 od 4780 (0,30%) bolesnika liječenih Actosom imalo je vrijednosti ALT-a ‰ times 3 puta više od gornje granice normale tijekom liječenja. Svi bolesnici s praćenim vrijednostima imali su reverzibilno povišeno ALT. U populaciji bolesnika liječenih Actos-om, prosječne vrijednosti bilirubina, AST-a, ALT-a, alkalne fosfataze i GGT-a smanjene su u posljednjem posjetu u usporedbi s početnom vrijednosti. Manje od 0,9% bolesnika liječenih Actosom povučeno je iz kliničkih ispitivanja u SAD-u zbog nenormalnih testova jetrene funkcije.
U kliničkim ispitivanjima koja su prethodila odobrenju nije bilo slučajeva idiosinkratskih reakcija lijekova koji bi doveli do zatajenja jetre (vidjeti MJERE OPREZA, Opći, jetreni efekti).
Razine CPK-a: Tijekom potrebnih laboratorijskih ispitivanja u kliničkim ispitivanjima primijećena su sporadična, prolazna povišenja razine kreatin fosfokinaze (CPK). Zabilježeno je izolirano povišenje veće od 10 puta više od gornje granice normale kod 9 bolesnika (vrijednosti od 2150 do 11400 IU / L). Šest takvih bolesnika nastavilo je primati Actos, a dva pacijenta su završila studij lijekove u vrijeme povišene vrijednosti i jedan je pacijent prekinuo ispitivanje lijekova zbog nadmorska visina. Ova su uzvišenja riješena bez ikakvih očitih kliničkih posljedica. Veza tih događaja s Actos terapijom nije poznata.
vrh
Predozirati
Tijekom kontroliranih kliničkih ispitivanja prijavljen je jedan slučaj predoziranja lijekom Actos. Muški pacijent uzimao je 120 mg dnevno četiri dana, a zatim 180 mg dnevno sedam dana. Pacijent je uskratio bilo kakve kliničke simptome tijekom ovog razdoblja.
U slučaju predoziranja potrebno je započeti odgovarajuće potporno liječenje u skladu s kliničkim znacima i simptomima pacijenta.
vrh
Doziranje i primjena
Actos treba uzimati jednom dnevno bez obzira na obroke.
Upravljanje antidijabetičkom terapijom treba biti individualizirano. U idealnom slučaju, odgovor na terapiju treba procijeniti pomoću HbA1c što je bolji pokazatelj dugoročne kontrole glikemije nego sam FPG. HbA1c odražava glikemiju u posljednja dva do tri mjeseca. U kliničkoj primjeni preporučuje se da se pacijenti liječe Actosom tijekom perioda koji je dovoljan za procjenu promjene razine HbA1c (tri mjeseca), osim ako se kontrola glikemije ne pogorša. Nakon započinjanja lijeka Actos ili s povećanjem doze, bolesnike treba pažljivo nadzirati zbog štetnih događaja povezanih sa zadržavanjem tekućine (vidjeti OKVIRNO UPOZORENJE i UPOZORENJA).
monoterapija
Monoterapija Actosom kod pacijenata koji nisu adekvatno kontrolirani dijetom i vježbanjem može se započeti s 15 mg ili 30 mg jednom dnevno. Za bolesnike koji neadekvatno reagiraju na početnu dozu Actosa, doza se može povećavati u koracima do 45 mg jednom dnevno. Kod pacijenata koji ne reagiraju na monoterapiju, treba razmotriti kombiniranu terapiju.
Kombinirana terapija
Sulfonilureje: Actos u kombinaciji sa sulfonilurejom može se započeti s 15 mg ili 30 mg jednom dnevno. Trenutna doza sulfonilureje može se nastaviti nakon započinjanja terapije Actosom. Ako pacijenti prijave hipoglikemiju, dozu sulfonilureje treba smanjiti.
Metformin: Actos u kombinaciji s metforminom može se započeti s 15 mg ili 30 mg jednom dnevno. Trenutna doza metformina može se nastaviti nakon započinjanja terapije Actosom. Malo je vjerojatno da će doza metformina zahtijevati prilagodbu zbog hipoglikemije tijekom kombinirane terapije s Actosom.
Inzulin: Actos u kombinaciji s inzulinom može se započeti s 15 mg ili 30 mg jednom dnevno. Trenutna doza inzulina može se nastaviti nakon započinjanja terapije Actosom. U bolesnika koji primaju Actos i inzulin, doza inzulina može se smanjiti za 10% do 25% ako pacijent prijavi hipoglikemiju ili ako se koncentracija glukoze u plazmi smanji na manje od 100 mg / dL. Daljnja prilagođavanja trebaju se individualizirati na temelju odgovora za snižavanje glukoze.
Maksimalna preporučena doza
Doza Actosa ne smije biti veća od 45 mg jednom dnevno u monoterapiji ili u kombinaciji sa sulfonilurejom, metforminom ili inzulinom.
Ne preporučuje se prilagođavanje doze u bolesnika s bubrežnom insuficijencijom (vidjeti KLINIČKA FARMAKOLOGIJA, Farmakokinetika i metabolizam lijekova).
Terapija Actosom ne smije se započeti ako pacijent pokaže kliničke dokaze aktivne bolesti jetre ili povećana razina transaminaze u serumu (ALT veća od 2,5 puta od gornje granice normale) na početku terapije (vidjeti MJERE OPREZA, Opće, jetreni efekti i KLINIČKA FARMAKOLOGIJA, Posebne populacije, jetrena insuficijencija). Praćenje jetrenih enzima preporučuje se u svih bolesnika prije početka liječenja Actosom i periodično nakon toga (vidjeti MJERE OPREZA, Opći, jetreni efekti).
Nema podataka o uporabi Actosa u bolesnika mlađih od 18 godina; stoga se ne preporučuje uporaba Actosa u pedijatrijskih bolesnika.
Nema podataka o primjeni Actosa u kombinaciji s drugim tiazolidindionom.
vrh
Kako se isporučuje
Actos je dostupan u tabletama od 15 mg, 30 mg i 45 mg kako slijedi:
15 mg tableta: bijela do gotovo bijela, okrugla, konveksna, bez ocjene tableta s "Actos" na jednoj strani i "15" na drugoj, dostupno u:
NDC 64764-151-04 Boce od 30
NDC 64764-151-05 Boce od 90
NDC 64764-151-06 Bočice od 500
30 mg tableta: bijela do gotovo bijela, okrugla, ravna, nezaslužena tableta s "Actos" na jednoj strani i "30" na drugoj, dostupno u:
NDC 64764-301-14 Boce od 30
NDC 64764-301-15 Boce od 90
NDC 64764-301-16 Bočice od 500
45 mg tableta: bijela do gotovo bijela, okrugla, ravna, nepotvrđena tableta s "Actos" na jednoj strani i "45" na drugoj, dostupno u:
NDC 64764-451-24 Boce od 30
NDC 64764-451-25 Boce od 90
NDC 64764-451-26 Boce od 500
SKLADIŠTENJE
Čuvati na 25 ° C; izleti dopušteni na 15-30 ° C (vidi temperaturu u prostoriji s USP kontroliranom zrakom). Čuvati spremnik čvrsto zatvorenim i zaštititi od vlage i vlage.
vrh
Reference
- Deng, LJ i sur. Učinak gemfibrozila na farmakokinetiku pioglitazona. Eur J Clin Pharmacol 2005; 61: 831-836, tablica 1.
2. Jaakkola, T i sur. Učinak rifampicina na farmakokinetiku pioglitazona. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Samo Rx
Proizveo:
Takeda Pharmaceutical Company Limited
Osaka, Japan
Označio:
Takeda Pharmaceuticals America, Inc.
Jedan park Takeda
Deerfield, IL 60015
Actos® je registrirani zaštitni znak kompanije Takeda Pharmaceutical Company Limited i koristi ga pod licencom tvrtke Takeda Pharmaceuticals America, Inc.
Sva druga imena zaštitnih znakova vlasništvo su njihovih vlasnika.
Ažurirano: 8.9
Actos, pioglitazone hcl, podaci o pacijentu (na običnom engleskom)
Detaljne informacije o znakovima, simptomima, uzrocima, liječenjima dijabetesa
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
natrag na: Pregledajte sve lijekove za dijabetes



