Apidra za liječenje dijabetesa
Naziv marke: Apidra
Generičko ime: inzulinska glulisina
Apidra (inzulinski glulisin) je umjetni proizvod koji je gotovo identičan ljudskom inzulinu. Koristi se za liječenje dijabetes melitusa. Upotreba, doziranje, nuspojave.
Sadržaj:
Indikacije i upotreba
Doziranje i primjena
kontraindikacije
Upozorenja i mjere opreza
Nuspojave
Interakcije s lijekovima
Upotreba u određenoj populaciji
predoziranje
Opis
Klinička farmakologija
Neklinička toksikologija
Kliničke studije
Kako se isporučuje
Apidra, inzulinski glusin, podaci o pacijentu (na običnom engleskom)
indikacije
Apidra je brzi analog ljudskog inzulina indiciran za poboljšanje kontrole glikemije u odraslih i djece sa šećernom bolešću.
vrh
Doziranje i primjena
Pitanja doziranja
APIDRA je rekombinantni analog inzulina koji je izjednačen s ljudskim inzulinom (tj. Jedna jedinica APIDRA ima isti učinak snižavanja glukoze kao i jedna jedinica normalnog ljudskog inzulina) ako se daje intravenski. Kada se daje supkutano, APIDRA ima brži početak djelovanja i kraće trajanje djelovanja od uobičajenog humanog inzulina.
Doziranje APIDRA-e mora biti individualizirano. Praćenje glukoze u krvi je neophodno u svih bolesnika koji su primali inzulinsku terapiju.
Ukupna dnevna potreba za inzulinom može varirati i obično je između 0,5 do 1 jedinica / kg / dan. Potrebe za inzulinom mogu se izmijeniti tijekom stresa, većih bolesti ili s promjenama u tjelovježbi, obrascima obroka ili lijekovima koji se primjenjuju istovremeno.
Subkutana primjena
APIDRA se treba davati unutar 15 minuta prije obroka ili u roku od 20 minuta nakon početka obroka.
APIDRA koja se daje supkutanom injekcijom općenito se treba koristiti u režimima s inzulinom srednjeg ili dugog djelovanja.
APIDRA se treba davati subkutanom injekcijom u trbušni zid, bedro ili nadlakticu. Mjesta ubrizgavanja trebaju se rotirati unutar iste regije (trbuha, bedara ili nadlaktice) od jedne do druge injekcije kako bi se smanjio rizik od lipodistrofije [Vidi NEPOVOLJNE REAKCIJE].
Kontinuirana potkožna infuzija (inzulinska pumpa)
APIDRA se može davati kontinuiranom potkožnom infuzijom u trbušnoj stijenci. Ne koristite razrijeđene ili miješane inzuline u vanjskim inzulinskim pumpama. Mjesta infuzije trebaju se rotirati unutar iste regije kako bi se smanjio rizik od lipodistrofije [Vidi NEPOVOLJNE REAKCIJE]. Početna programiranja pumpe za vanjsku infuziju inzulina trebaju se temeljiti na ukupnoj dnevnoj dozi inzulina iz prethodnog režima.
Slijedeće pumpe za inzulin korištene su u kliničkim ispitivanjima APIDRA-e koje je proveo sanofi-aventis, proizvođač APIDRA-e:
- Disetronic® H-Tron® plus V100 i D-Tron® s Disetronic kateterima (Rapid ™, Rapid C ™, Rapid D ™ i Tender ™)
- MiniMed® Modeli 506, 507, 507c i 508 s MiniMed kateterima (Sof-set Ultimate QR ™ i Quick-set ™).
Prije upotrebe neke druge inzulinske crpke s APIDRA-om, pročitajte naljepnicu crpke kako biste bili sigurni da je pumpa procijenjena s APIDRA-om.
Liječnici i pacijenti trebaju pažljivo procijeniti podatke o korištenju crpke u APIDRA propisanim podacima, Uputama za informiranje o pacijentu i u priručniku proizvođača pumpe. Informacije o specifičnosti APIDRE trebaju se slijediti tijekom upotrebe, učestalosti mijenjanja infuzijskih seta ili drugih pojedinosti specifične za uporabu APIDRA-e, jer se APIDRA-specifične informacije mogu razlikovati od općih priručnika za crpke upute.
Na temelju in vitro studija koje su pokazale gubitak degradacije konzervansa, metakrezola i inzulina, APIDRA u rezervoaru treba mijenjati najmanje svakih 48 sati. APIDRA u kliničkoj uporabi ne smije biti izložena temperaturama većim od (37 ° C) većim od 98,6 ° F. [Vidjeti UPOZORENJA I UPOZORENJE i KAKO DOSTAVA / Skladištenje i rukovanje].
Intravenska primjena
APIDRA se može davati intravenski pod liječničkim nadzorom za kontrolu glikemije uz pažljivo praćenje glukoze u krvi i kalija u serumu kako bi se izbjegle hipoglikemija i hipokalemija. Za intravensku upotrebu, APIDRA treba koristiti u koncentraciji od 0,05 jedinica / ml do 1 jedinice / ml inzulinskog glulisina u infuzijskim sustavima koristeći vrećice polivinilklorida (PVC). Pokazalo se da je APIDRA stabilan samo u normalnoj fiziološkoj otopini (0,9% natrijevog klorida). Parenteralne proizvode s lijekovima treba vizualno pregledati kako sadrže čestice i promjenu boje prije primjene, kad god otopina i spremnici dopuštaju. Nemojte davati smjese inzulina intravenski.
Oblici i snage doziranja
Apidra 100 jedinica po mL (U-100) je dostupna kao:
- 10 ml bočice
- Uložak od 3 ml za upotrebu u OptiClik-u® Uređaj za dostavu inzulina
- 3 ml SoloStar napunjena olovka
vrh
kontraindikacije
Apidra je kontraindicirana:
- tijekom epizoda hipoglikemije
- u bolesnika koji su preosjetljivi na Apidru ili na bilo koji od njegovih pomoćnih sastojaka
Kada se koristi u bolesnika s poznatom preosjetljivošću na Apidru ili na njegove pomoćne tvari, pacijenti mogu razviti lokalizirane ili generalizirane reakcije preosjetljivosti [Vidi Nuspojave].
vrh
Upozorenja i mjere opreza
Prilagodba i nadzor doze
Praćenje glukoze neophodno je za pacijente koji primaju inzulinsku terapiju. Promjene režima inzulina trebaju se vršiti oprezno i samo pod liječničkim nadzorom. Promjene u jakosti inzulina, proizvođaču, vrsti ili načinu primjene mogu rezultirati potrebom za promjenom doze inzulina. Moguće je podesiti suvremeno oralno antidijabetičko liječenje.
Kao i kod svih inzulinskih pripravaka, vremenski tijek djelovanja za Apidra može varirati kod različitih pojedinaca ili u različitim vremenima u ista osoba i ovisan je o mnogim uvjetima, uključujući mjesto ubrizgavanja, lokalnu opskrbu krvlju ili lokalno temperatura. Bolesnicima koji mijenjaju razinu tjelesne aktivnosti ili plan obroka može biti potrebna prilagodba doza inzulina.
Hipoglikemija
Hipoglikemija je najčešća nuspojava terapije inzulinom, uključujući Apidru. Rizik od hipoglikemije povećava se pooštrenom kontrolom glikemije. Pacijenti se moraju educirati da prepoznaju i upravljaju hipoglikemijom. Teška hipoglikemija može dovesti do nesvijesti i / ili konvulzija i može rezultirati privremenim ili trajnim oštećenjem moždanih funkcija ili smrću. Teška hipoglikemija koja zahtijeva pomoć druge osobe i / ili parenteralna infuzija glukoze ili primijećena je primjena glukagona u kliničkim ispitivanjima inzulina, uključujući ispitivanja s Apidra®.
Vreme hipoglikemije obično odražava profil vremenskog djelovanja primijenjenih inzulinskih formulacija. Ostali čimbenici poput promjena unosa hrane (npr. Količina hrane ili vremena obroka), mjesta ubrizgavanja, vježbanja i istodobnih lijekova također mogu promijeniti rizik od hipoglikemije [Vidi Interakcije s lijekovima].
Kao i kod svih inzulina, budite oprezni u bolesnika s nesvjesnošću hipoglikemije i kod bolesnika koji mogu biti predisponirani za hipoglikemiju (npr. pedijatrijska populacija i pacijenti koji postižu ili imaju pogrešnu hranu unos). Pacijentova sposobnost koncentracije i reakcije može biti oslabljena kao rezultat hipoglikemije. To može predstavljati rizik u situacijama u kojima su ove sposobnosti osobito važne, poput vožnje ili upravljanja drugim strojevima.
Brze promjene razine glukoze u serumu mogu izazvati simptome slične hipoglikemiji kod osoba s dijabetesom, bez obzira na vrijednost glukoze. Simptomi ranog upozoravanja hipoglikemije mogu biti različiti ili manje izraženi pod određenim uvjetima, kao što su dugogodišnji dijabetes, dijabetička bolest živaca, uporaba lijekova poput beta blokatora [Vidi Interakcije s lijekovima] ili pojačana kontrola dijabetesa. Te situacije mogu rezultirati ozbiljnom hipoglikemijom (i, možda, gubitkom svijesti) prije nego što pacijent postane svjestan hipoglikemije.
Intravenski primijenjeni inzulin ima brži početak djelovanja od inzulina koji se daje supkutano, pa je potrebno pažljivije nadgledanje hipoglikemije.
Preosjetljivost i alergijske reakcije
Teške, po život opasne, generalizirane alergije, uključujući anafilaksiju, mogu se pojaviti s inzulinskim proizvodima, uključujući Apidru [Vidi Nuspojave].
hypokalemia
Svi inzulinski proizvodi, uključujući Apidru, uzrokuju pomak kalija iz vanćelijskog u unutarćelijski prostor, što može dovesti do hipokalemije. Neliječena hipokalemija može uzrokovati respiratornu paralizu, ventrikularnu aritmiju i smrt. Budite oprezni u bolesnika koji mogu biti u riziku od hipokalemije (npr. Bolesnika koji koriste lijekove za smanjenje kalija, bolesnika koji uzimaju lijekove osjetljive na koncentraciju kalija u serumu). Često primijenite glukozu i kalij kada se Apidra daje intravenski.
Bubrežno ili jetreno oštećenje
U bolesnika s oštećenjem bubrega ili jetre može biti potreban čest nadzor glukoze i smanjenje doze inzulina [Vidi Klinička farmakologija].
Miješanje inzulina
Apidra za potkožno ubrizgavanje ne smije se miješati s inzulinskim pripravcima koji nisu NPH inzulin. Ako se Apidra pomiješa s NPH inzulinom, prvo ga treba uvući u špricu. Injekcija se mora dogoditi odmah nakon miješanja.
Nemojte miješati Apidra s drugim insulinama za intravensku primjenu ili za uporabu u kontinuiranoj potkožnoj infuzijskoj pumpi.
Apidra za intravensku primjenu ne smije se razrjeđivati otopinama koje nisu 0.9% natrijevog klorida (uobičajena fiziološka otopina). Djelotvornost i sigurnost miješanja Apidre s razrjeđivačima ili drugim inzulinama za uporabu u vanjskim potkožnim crpkama za infuziju nisu utvrđene.
Infuzijske pumpe za potkožni inzulin
Kada se koristi u vanjskoj inzulinskoj pumpi za potkožnu infuziju, Apidra se ne smije razrjeđivati ili miješati s bilo kojim drugim inzulinom. Apidru u rezervoaru treba mijenjati najmanje svakih 48 sati. Apidra ne smije biti izložena temperaturama većim od 37 ° C iznad 98,6 ° F.
Neispravnost inzulinske pumpe ili infuzijskog seta ili razgradnja inzulina mogu brzo dovesti do hiperglikemije i ketoze. Potrebno je brzo identificirati i ispraviti uzrok hiperglikemije ili ketoze. Možda će biti potrebne privremene subkutane injekcije Apidrom. Pacijenti koji koriste kontinuiranu terapiju potkožne infuzije infuzijom moraju biti osposobljeni za primjenu inzulina injekcijom i imati alternativnu inzulinsku terapiju u slučaju zatajenja pumpe. [Vidjeti Doziranje i primjena, Način isporuke / skladištenja i rukovanje].
Intravenska primjena
Kada se Apidra primjenjuje intravenski, razine glukoze i kalija moraju se pažljivo nadzirati kako bi se izbjegle potencijalno fatalne hipoglikemije i hipokalemije.
Nemojte miješati Apidra s drugim insulinama za intravensku primjenu. Apidra se može razrijediti samo u normalnoj fiziološkoj otopini.
Interakcije s lijekovima
Neki lijekovi mogu promijeniti potrebe za inzulinom i rizik za hipoglikemiju ili hiperglikemiju [Vidi Interakcije s lijekovima].
vrh
Nuspojave
Sljedeće nuspojave raspravljaju se drugdje:
- Hipoglikemija [Vidi Upozorenja i mjere opreza]
- Hipokalemija [Vidi Upozorenja i mjere opreza]
Iskustvo s kliničkim ispitivanjima
Budući da se klinička ispitivanja provode prema jako različitom dizajnu, stopa nuspojava prijavljena u jednom kliničkom ispitivanju možda neće lako se uspoređuje s stopama prijavljenim u drugom kliničkom ispitivanju i ne mora odražavati stope stvarno uočene u kliničkom ispitivanju praksa.
Učestalost nuspojava lijekova tijekom kliničkih ispitivanja Apidre u bolesnika sa šećernom bolešću tipa 1 i šećernom bolešću tipa 2 navedene su u donjim tablicama.
Tablica 1: Lijekovi - neželjeni štetni događaji u skupnim studijama odraslih s dijabetesom tipa 1 (nuspojave s učestalošću ‰ ¥ 5%)
| APIDRA,% (N = 950) |
Svi usporednici, % (N = 641) |
|
| Nasopharyngitis | 10.6 | 12.9 |
| Hipoglikemijab | 6.8 | 6.7 |
| Infekcija gornjih dišnih puteva | 6.6 | 5.6 |
| gripa | 4.0 | 5.0 |
|
Inzulin lispro, obični humani inzulin, inzulin aspart b Samo jaka simptomatska hipoglikemija |
Tablica 2: Lijekovi - neželjeni štetni događaji u skupnim studijama odraslih s dijabetesom tipa 2 (nuspojave s učestalošću frequency ¥ 5%)
| APIDRA,% (N = 883) |
Redoviti humani inzulin,% (N = 883) |
|
| Infekcija gornjih dišnih puteva | 10.5 | 7.7 |
| Nasopharyngitis | 7.6 | 8.2 |
| Edemski periferni | 7.5 | 7.8 |
| gripa | 6.2 | 4.2 |
| artralgija | 5.9 | 6.3 |
| Hipertenzija | 3.9 | 5. |
- pedijatrija
Tablica 3 sažima nuspojave koje su se pojavile s učestalošću većom od 5% u kliničkoj studiji u djece i adolescenata s dijabetesom tipa 1 liječenih APIDRA-om (n = 277) ili inzulinom lispro (N = 295).
Tablica 3: Liječenje - neželjeni štetni događaji kod djece i adolescenata s dijabetesom tipa 1 (nuspojave s učestalošću ‰ ¥ 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| Nasopharyngitis | 9.0 | 9.5 |
| Infekcija gornjih dišnih puteva | 8.3 | 10.8 |
| Glavobolja | 6.9 | 11.2 |
| Hipoglikemijski napadaj | 6.1 | 4.7 |
- Teška simptomatska hipoglikemija
Hipoglikemija je najčešće uočena nuspojava kod pacijenata koji koriste inzulin, uključujući Apidru [Vidi Upozorenja i mjere opreza]. Stope i učestalost teške simptomatske hipoglikemije, definirane kao hipoglikemija koja zahtijeva intervenciju treće strane, bile su usporedive za sve režime liječenja (vidjeti tablicu 4). U kliničkoj studiji faze 3, djeca i adolescenti s dijabetesom tipa 1 imali su veću učestalost teške simptomatske hipoglikemije u dvije skupine liječenja u usporedbi s odraslim osobama tipa 1 dijabetes. (vidi tablicu 4) [Vidi Kliničke studije].
Tablica 4: Teška simptomatska hipoglikemija *
| Dijabetes tipa 1 Odrasli 12 tjedana s inzulinom glargin |
Dijabetesi odraslih tipa 1 26 tjedana s inzulinom glargin |
Dijabetes tipa 2 Odrasli 26 tjedana s ljudskim inzulinom NPH |
Dijabetes dijabetesa tipa 1 26 tjedana |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra® Prije obroka |
Apidra® Poslije obroka |
Redoviti ljudski inzulin | Apidra® | Insulin Lispro | Apidra® | Redoviti ljudski inzulin | Apidra® | Inzulin Lispr | |
| * Teška simptomatska hipoglikemija definirana kao hipoglikemijski događaj koji zahtijeva pomoć druge osobe koja ispunjava jedan od sljedećih kriterija: događaj je povezan s krvnom glukozom u krvi punom krvi <36 mg / dL ili je događaj povezan s brzim oporavkom nakon oralne primjene ugljikohidrata, intravenske glukoze ili glukagona. | |||||||||
| Događaji mjesečno po pacijentu | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Postotak pacijenata (n / ukupno N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Pokretanje inzulina i intenziviranje kontrole glukoze
Intenziviranje ili brzo poboljšanje kontrole glukoze povezano je s prolaznim, reverzibilnim poremećaj oftalmološke refrakcije, pogoršanje dijabetičke retinopatije i akutna bolna periferna neuropatija. Međutim, dugotrajna kontrola glikemije smanjuje rizik od dijabetičke retinopatije i neuropatije.
- lipodistrofija
Dugotrajna primjena inzulina, uključujući Apidru, može uzrokovati lipodistrofiju na mjestu ponovljenih injekcija ili infuzije inzulina. Lipodistrofija uključuje lipohipertrofiju (zadebljanje masnog tkiva) i lipoatrofiju (stanjivanje masnog tkiva), a može utjecati na apsorpciju inzulina. Zakrenite mjesta ubrizgavanja ili infuzije inzulina unutar iste regije kako biste smanjili rizik od lipodistrofije. [Vidjeti Doziranje i primjena].
- Debljanje
Debljanje se može dogoditi s inzulinskom terapijom, uključujući Apidru, i pripisano je anaboličkim učincima inzulina i smanjenju glukozurije.
- Periferni edem
Inzulin, uključujući Apidru, može uzrokovati zadržavanje natrija i edeme, osobito ako je prethodno loša metabolička kontrola poboljšana intenzivnom terapijom inzulinom.
- Nuspojave s kontinuiranom subkutanom infuzijom inzulina (CSII)
U randomiziranoj studiji u 12 tjedana kod bolesnika s dijabetesom tipa 1 (n = 59), stope katetera okluzije i reakcije na mjestu infuzije bile su slične kod pacijenata liječenih Apidrom i inzulinom aspartom (Tablica 5).
Tablica 5: Okluzije katetera i reakcije na mjestu infuzije.
| Apidra® (N = 29) |
inzulin aspart (N = 30) |
|
|---|---|---|
| Okluzija katetera / mjesec | 0.08 | 0.15 |
| Reakcije na mjestu infuzije | 10.3% (3/29) | 13.3% (4/30) |
- Alergijske reakcije
Lokalna alergija
Kao i kod bilo koje inzulinske terapije, i pacijenti koji uzimaju Apidru mogu na mjestu ubrizgavanja osjetiti crvenilo, oticanje ili svrbež. Ove manje reakcije obično se javljaju za nekoliko dana do nekoliko tjedana, ali u nekim slučajevima mogu zahtijevati prekid liječenja Apidre. U nekim slučajevima ove reakcije mogu biti povezane s drugim faktorima osim inzulina, kao što su iritanti u sredstvu za čišćenje kože ili loša tehnika ubrizgavanja.
Sistemska alergija
Teška, po život opasna, generalizirana alergija, uključujući anafilaksiju, može se pojaviti na bilo koji inzulin, uključujući Apidru. Generalizirana alergija na inzulin može uzrokovati osip po cijelom tijelu (uključujući pruritus), dispneju, piskanje, hipotenziju, tahikardiju ili dijaforezu.
U kontroliranim kliničkim ispitivanjima u trajanju do 12 mjeseci, prijavljene su potencijalne sistemske alergijske reakcije u 79 bolesnika 1833 pacijenta (4,3%) koji su primali Apidru i 58 od 1524 pacijenta (3,8%) koji su primali komparativni lijek inzulini. Tijekom ovih ispitivanja liječenje Apidrom trajno je obustavljeno kod 1 od 1833 bolesnika zbog potencijalne sistemske alergijske reakcije.
Izvještene su o lokaliziranim reakcijama i generaliziranim mialgijama uz uporabu metakresola, koji je pomoćni sastojak Apidre.
Proizvodnja antitijela
U studiji bolesnika s dijabetesom tipa 1 (n = 333), koncentracije protutijela za inzulin koje reagiraju i na humani i na inzulin glulisin (unakrsna reaktivna antitijela za inzulin) ostao je blizu početne vrijednosti tijekom prvih 6 mjeseci ispitivanja u bolesnika liječenih Apidra®. U sljedećih 6 mjeseci ispitivanja primijećeno je smanjenje koncentracije antitijela. U studiji na pacijentima s dijabetesom tipa 2 (n = 411), sličan porast unakrsne reaktivne koncentracije protutijela za inzulin bio je primijećeno u bolesnika liječenih Apidrom i u bolesnika liječenih ljudskim inzulinom tijekom prvih 9 mjeseci liječenja studij. Nakon toga koncentracija protutijela se smanjila kod pacijenata s Apidrom i ostala je stabilna u bolesnika s humanim inzulinom. Nije postojala povezanost između unakrsne reakcijske koncentracije antitijela inzulina i promjena u HbA1c, dozi inzulina ili učestalosti hipoglikemije. Klinički značaj ovih antitijela nije poznat.
Apidra nije izazvala značajan odgovor na antitijela u ispitivanju djece i adolescenata sa dijabetesom tipa 1.
Iskustvo nakon prodaje
Sljedeće nuspojave utvrđene su tijekom primjene Apidre nakon odobrenja.
Budući da se ove reakcije dobrovoljno prijavljuju iz populacije nesigurne veličine, to nisu uvijek je moguće pouzdano procijeniti njihovu učestalost ili uspostaviti uzročno-posljedičnu vezu s drogom izloženost.
Zabilježene su pogreške u lijekovima kod kojih su umjesto Apidre slučajno davani drugi inzulini, osobito dugo djelujući inzulini.
vrh
Interakcije s lijekovima
Brojni lijekovi utječu na metabolizam glukoze i mogu zahtijevati prilagođavanje doze inzulina i posebno pažljivo praćenje.
Lijekovi koji mogu povećati učinak inzulina na snižavanje glukoze u krvi, uključujući Apidru, i stoga povećati rizik od hipoglikemije, uključuju oralne antidijabetičke proizvode, pramlintid, ACE inhibitori, disopiramid, fibrati, fluoksetin, inhibitori monoamin oksidaze, propoksifen, pentoksifilin, salicilati, somatostatin analozi i sulfonamid antibiotici.
Lijekovi koji mogu smanjiti učinak Apidre na snižavanje glukoze u krvi uključuju kortikosteroide, niacin, danazol, diuretike, simpatomimetičke agense (npr. Epinefrin, albuterol, terbutalin), glukagon, izoniazid, fenotiazinski derivati, somatropin, hormoni štitnjače, estrogeni, progestogeni (npr., u oralnim kontraceptivima), inhibitori proteaze i atipični antipsihotici.
Beta blokatori, klonidin, litijeve soli i alkohol mogu ili povećati ili smanjiti učinak inzulina na snižavanje glukoze u krvi.
Pentamidin može izazvati hipoglikemiju, koja ponekad može biti praćena hiperglikemijom.
Znakovi hipoglikemije mogu biti smanjeni ili odsutni u bolesnika koji uzimaju anti-adrenergičke lijekove poput beta blokatora, klonidina, gvanetidina i rezerpina.
vrh
Upotreba u određenoj populaciji
Trudnoća
Trudnoća Kategorija C: Ispitivanja reprodukcije i teratologije provedena su s glulisinom inzulina na štakorima i kunićima koristeći uobičajeni humani inzulin kao usporednik. Inzulinski glulisin daje se ženkama štakorima tijekom trudnoće u potkožnim dozama do 10 jedinica / kg jednom dnevno (doza rezultira u izloženost 2 puta veća od prosječne doze za ljude na temelju usporedbe površine tijela) i nije imala zapažene toksične učinke na embrionalno-fetus razvoj.
Inzulinski glulisin daje se ženkama kunićima tijekom trudnoće u potkožnim dozama do 1,5 Jedinice / kg / dan (doza koja rezultira izlaganjem 0,5 puta većom od prosječne ljudske doze, ovisno o površini tijela usporedba). Neželjeni učinci na embrionalno-fetalni razvoj zabilježeni su samo kod razine toksične doze za majku, koja inducira hipoglikemiju. Uočena je veća učestalost postimplantacijskih gubitaka i koštanih oštećenja pri razini doze od 1,5 jedinica / kg jednom dnevno (doza što rezultira izlaganjem 0,5 puta većom od prosječne ljudske doze, na temelju usporedbe površine tijela) što je također uzrokovalo smrtnost u brane. Lagana povećana učestalost gubitaka nakon implantacije primijećena je kod sljedeće razine doze od 0,5 jedinica / kg jednom dnevno (doza rezultira izloženošću 0,2 puta veća od prosječne doze za ljude, na temelju usporedbe površine tijela) što je također bilo povezano s teškom hipoglikemijom, ali nije bilo oštećenja u tome doza. Nisu primijećeni učinci kod kunića u dozi od 0,25 jedinica / kg jednom dnevno (doza koja rezultira izlaganjem 0,1 puta većom od prosječne doze za ljude, na temelju usporedbe površine tijela). Učinci inzulina glulisina nisu se razlikovali od onih primijećenih s supkutanim redovitim ljudskim inzulinom u istim dozama, a pripisani su sekundarnim učincima majčinske hipoglikemije.
Ne postoje dobro kontrolirane kliničke studije o uporabi Apidre u trudnica. Budući da studije reprodukcije životinja ne predviđaju uvijek ljudski odgovor, ovaj lijek treba koristiti tijekom trudnoće samo ako potencijalna korist opravdava potencijalni rizik za plod. Za pacijente s dijabetesom ili poviješću gestacijskog dijabetesa ključno je održavati dobru metaboličku kontrolu prije začeća i tijekom trudnoće. Potrebe za inzulinom mogu se smanjiti tijekom prvog tromjesečja, uglavnom se povećavaju tijekom drugog i trećeg tromjesečja i brzo opadaju nakon porođaja. Pažljivo praćenje kontrole glukoze u ovim je bolesnicima bitno.
Negovane majke
Nije poznato izlučuje li se glulin iz inzulina u majčinom mlijeku. Budući da se mnogi lijekovi izlučuju u majčino mlijeko, oprez treba biti oprezan kada se Apidra primjenjuje dojiljama. Primjena Apidre kompatibilna je s dojenjem, ali ženama s dijabetesom koji doje mogu biti potrebne prilagodbe doze inzulina.
Primjena u djece
Sigurnost i učinkovitost supkutanih injekcija Apidre utvrđene su u pedijatrijskih bolesnika (u dobi od 4 do 17 godina) s dijabetesom tipa 1 [Vidi Kliničke studije]. Apidra nije proučavan u pedijatrijskih bolesnika s dijabetesom tipa 1 mlađih od 4 godine i u pedijatrijskih bolesnika s dijabetesom tipa 2.
Kao i kod odraslih, doza Apidre se mora individualizirati u pedijatrijskih bolesnika na temelju metaboličkih potreba i učestalog praćenja glukoze u krvi.
Gerijatrijska upotreba
U kliničkim ispitivanjima (n = 2408) Apidra je primjenjivan na 147 bolesnika u dobi od 65 godina i 27 bolesnika u dobi od 75 godina. Većina ove male podskupine starijih bolesnika imala je dijabetes tipa 2. Promjena vrijednosti HbA1c i frekvencije hipoglikemije nisu se razlikovale u dobi. Ipak treba biti oprezan kad se Apidra primjenjuje na gerijatrijske bolesnike.
vrh
predoziranje
Prekomjerni inzulin može uzrokovati hipoglikemiju i, posebno ako se daje intravenski, hipokalemiju. Blage epizode hipoglikemije obično se mogu liječiti oralnom glukozom. Možda će biti potrebne prilagodbe doziranja lijekova, obrasca obroka ili vježbanja. Teže epizode hipoglikemije s komom, napadajem ili neurološkim oštećenjem mogu se liječiti intramuskularnim / potkožnim glukagonom ili koncentriranom intravenskom glukozom. Trajni unos ugljikohidrata i promatranje mogu biti potrebni jer se hipoglikemija može ponoviti nakon očitog kliničkog oporavka. Hipokalemija se mora ispravno ispraviti.
Opis
Apidra® (injekcija inzulina glulisin [rDNA porijeklo]) je brzi analog ljudskog inzulina koji se koristi za snižavanje glukoze u krvi. Inzulinski glulisin proizvodi se rekombinantnom DNK tehnologijom koristeći nepatogeni laboratorijski soj Escherichia coli (K12). Inzulinski glulisin razlikuje se od humanog inzulina po tome što je aminokiselina asparagin u položaju B3 zamijenjena lizinom, a lizin u položaju B29 zamijenjen glutaminskom kiselinom. Kemijski, inzulinski glulisin je humani inzulin 3B-lizin-29B-glutaminske kiseline, ima empirijsku formulu C258H384N64O78S6 i molekulsku masu 5823 i ima sljedeću strukturnu formulu:
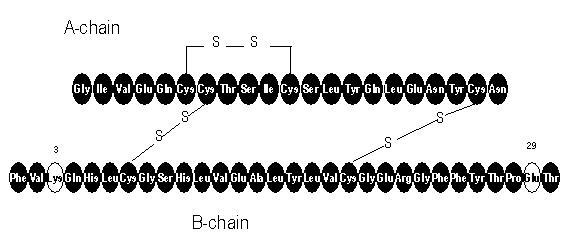
Apidra je sterilna, vodena, bistra i bezbojna otopina. Svaki mililitar Apidre sadrži 100 jedinica (3,49 mg) inzulinskog glulisina, 3,15 mg metakrezola, 6 mg trometamina, 5 mg natrijevog klorida, 0,01 mg polisorbata 20 i vode za injekcije. Apidra ima pH od približno 7,3. PH se podešava dodavanjem vodenih otopina klorovodične kiseline i / ili natrijevog hidroksida.
vrh
Klinička farmakologija
Mehanizam djelovanja
Regulacija metabolizma glukoze primarna je aktivnost inzulina i analoga inzulina, uključujući inzulin glulisin. Inzulini snižavaju glukozu u krvi stimulišući periferni unos glukoze skeletnim mišićima i masnoćom i inhibirajući stvaranje jetrene glukoze. Insulini inhibiraju lipolizu i proteolizu i pojačavaju sintezu proteina.
Aktivnosti snižavanja glukoze Apidre i redovitog ljudskog inzulina izjednačene su kada se primjenjuju intravenskim putem. Nakon supkutane primjene, učinak Apidre je brži u početku i kraćem trajanju u usporedbi s običnim ljudskim inzulinom. [Vidi Farmakodinamika].
farmakodinamiku
Studije na zdravim dobrovoljcima i pacijentima s dijabetesom pokazale su da Apidra ima brže početak djelovanja i kraće trajanje aktivnosti od uobičajenog ljudskog inzulina kada se daje potkožno.
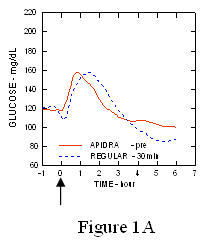
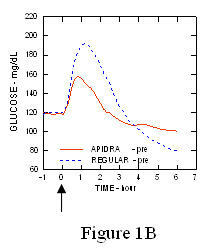
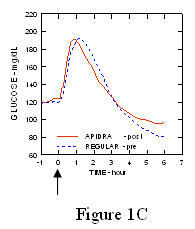
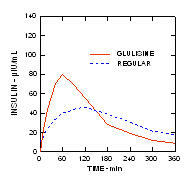
U studiji na pacijentima s dijabetesom tipa 1 (n = 20), profili Apidre i. Za snižavanje glukoze redoviti humani inzulin procijenjen je u različito vrijeme u odnosu na standardni obrok u dozi od 0,15 Jedinica / kg. (Slika 1.)
Maksimalna ekskurzija glukoze u krvi (Î ”GLUmax; oduzeta osnovna koncentracija glukoze) za Apidru ubrizganu 2 minute prije obroka bio je 65 mg / dL u usporedbi sa 64 mg / dL za normalne ljude injicirani inzulin 30 minuta prije obroka (vidjeti sliku 1A), i 84 mg / dL za redoviti humani inzulin ubrizgan 2 minute prije obroka (vidjeti sliku 1B). Maksimalna ekskurzija glukoze u krvi za Apidru ubrizgan 15 minuta nakon početka obroka bila je 85 mg / dL u usporedbi s 84 mg / dL za obični humani inzulin ubrizgan 2 minute prije obroka (vidjeti sliku 1C).
Slika 1. Serijski prosječna glukoza u krvi prikupljena do 6 sati nakon jedne doze Apidre i redovitog ljudskog inzulina. Apidra je dobila 2 minute (Apidra - prije) prije početka obroka u usporedbi s uobičajenim ljudskim inzulinom danim 30 minuta (Uobičajeno - 30 min) prije početka obroka (slika 1A) i uspoređeno s uobičajenim ljudskim inzulinom (redovito - prije) koje se daje 2 minute prije obroka (slika 1B). Apidra je dobila 15 minuta (Apidra - post) nakon početka obroka u usporedbi s uobičajenim ljudskim inzulinom (Regularno - prije) koji se daje 2 minute prije obroka (Slika 1C). Na nuli osi x (0) početak je obroka od 15 minuta.
 |
 |
 |
 |
U randomiziranom, otvorenom, dvosmjernom unakrsnom istraživanju, 16 zdravih muškaraca dobilo je intravensku terapiju infuzija Apidre ili običnog humanog inzulina s fiziološkim razrjeđivačem, brzinom od 0,8 miliUit / kg / min za dvije sati. Infuzija iste doze Apidre ili uobičajenog humanog inzulina daje ravnotežu glukoze u stanju mirovanja.
farmakokinetika
Apsorpcija i bioraspoloživost
Farmakokinetički profili kod zdravih dobrovoljaca i bolesnika s dijabetesom (tip 1 ili tip 2) pokazali su da je apsorpcija glulisina inzulina brža nego kod uobičajenog ljudskog inzulina.
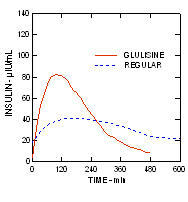
U ispitivanju bolesnika s dijabetesom tipa 1 (n = 20) nakon supkutane primjene 0,15 jedinica / kg, srednja vrijednost do maksimalne koncentracije (Tmax) bila je 60 minuta (raspon 40 do 120 minuta), a maksimalna koncentracija (Cmax) bila je 83 mikroUnita / ml (raspon 40 do 131 mikroUnita / ml) za inzulinski glulisin u usporedbi s medijanom Tmax od 120 minuta (raspon 60 do 239 minuta) i Cmax od 50 mikroUnita / ml (raspon 35 do 71 mikroUnita / ml) za normalne ljude inzulin. (Slika 2)
Slika 2. Farmakokinetički profili inzulina glulisina i redovitog humanog inzulina u bolesnika s dijabetesom tipa 1 nakon doze od 0,15 jedinica / kg.
Inzulinski glulisin i uobičajeni humani inzulin davani su supkutano u dozi od 0,2 jedinica / kg u anu Euglycemic clamp studija u bolesnika s dijabetesom tipa 2 (n = 24) i indeks tjelesne mase (BMI) između 20 i 36 kg / m2. Medijan vremena do maksimalne koncentracije (Tmax) bio je 100 minuta (raspon 40 do 120 minuta), a srednja vršna koncentracija (Cmax) bila je 84 mikroUnita / mL (raspon 53 do 165 mikroUnita / mL) za glulisin inzulina u usporedbi s medijanom Tmax od 240 minuta (raspon 80 do 360 minuta) i medijanom Cmax od 41 mikroUnits / mL (raspon 33 do 61 mikroUnita / mL) za uobičajeni humani inzulin. (Slika 3.)
Slika 3. Farmakokinetički profili inzulina glulisina i redovitog humanog inzulina u bolesnika s dijabetesom tipa 2 nakon potkožne doze od 0,2 Jedinice / kg.
Kada se Apidra ubrizgava supkutano u različita područja tijela, profili vremenske koncentracije bili su slični. Apsolutna bioraspoloživost inzulina glulisina nakon supkutane primjene iznosi oko 70%, bez obzira na područje ubrizgavanja (trbuh 73%, deltoid 71%, bedro 68%).
U kliničkoj studiji na zdravim dobrovoljcima (n = 32) ukupna bioraspoloživost inzulina glulisina bila je slična nakon potkožne ubrizgavanje inzulina glulisin i NPH inzulina (pomiješano u štrcaljki) i nakon odvojene istodobne potkožne injekcije. Bilo je 27% prigušivanje maksimalne koncentracije (Cmax) Apidre nakon miješanja; međutim, vrijeme na maksimalnu koncentraciju (Tmax) nije utjecalo. Nema podataka o miješanju Apidre s inzulinskim pripravcima koji nisu NPH inzulin. [Vidjeti Kliničke studije].
Distribucija i eliminacija
Distribucija i eliminacija inzulina glulisin i redovitog ljudskog inzulina nakon intravenske primjena je slična količini distribucije od 13 i 21 L i poluživotu od 13 i 17 minuta, odnosno. Nakon supkutane primjene, inzulinski glulisin se eliminira brže od uobičajenog ljudskog inzulina s prividnim poluživotom od 42 minute u odnosu na 86 minuta.
Klinička farmakologija u specifičnim populacijama
Pedijatrijski bolesnici
Farmakokinetička i farmakodinamička svojstva Apidre i redovitog humanog inzulina ocijenjena su u a studija provedena na djeci od 7 do 11 godina (n = 10) i adolescentima od 12 do 16 godina (n = 10) s tipom 1 dijabetes. Relativne razlike u farmakokinetikama i farmakodinamikama između Apidre i običnog humanog inzulina u ovi bolesnici s dijabetesom tipa 1 bili su slični onima u zdravih odraslih ispitanika i odraslih s tipom 1 dijabetes.
utrka
Ispitivanje 24 zdravih bijelaca i japanskih ispitanika uspoređivalo je farmakokinetiku i farmakodinamiku nakon supkutane injekcije inzulina glulisina, inzulina lispro i redovitog ljudskog inzulina. Uz potkožnu injekciju inzulina glulisina, japanski su ispitanici imali veću početnu izloženost (33%) za omjer AUC (0-1h) i AUC (kraj 0-stezaljke) od bijelaca (21%), iako su ukupne izloženosti bile sličan. Bilo je sličnih nalaza s inzulinom lispro i redovitim ljudskim inzulinom.
gojaznost
Insulinski glulisin i uobičajeni humani inzulin davani su supkutano u dozi od 0,3 jedinica / kg u a studija euglikemijske stezanja kod pretilih, ne-dijabetičara (n = 18) s indeksom tjelesne mase (BMI) između 30 i 40 kg / m2. Medijan vremena do maksimalne koncentracije (Tmax) bio je 85 minuta (raspon 49 do 150 minuta), a srednja vršna koncentracija (Cmax) bila je 192 mikroUit / mL (raspon 98 do 380 mikroUnita / mL) za glulisin inzulina u usporedbi s medijanom Tmax od 150 minuta (raspon 90 do 240 minuta) i srednjim Cmax od 86 mikroUnita / ml (raspon 43 do 175 mikroUnita / ml) za normalne ljude inzulin.
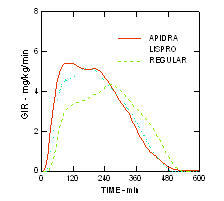
Brži početak djelovanja i kraće trajanje aktivnosti Apidre i inzulina lispro održavani su u pretiloj populaciji koja nema dijabetes (n = 18). (Slika 4.)
Slika 4. Brzina infuzije glukoze (GIR) u studiji euglikemijske stezaljke nakon potkožne injekcije 0,3 jedinica / kg Apidre, inzulina lispro ili redovitog ljudskog inzulina u pretiloj populaciji.
Oštećenje bubrega
Studije s ljudskim inzulinom pokazale su povećane razine inzulina u cirkulaciji u bolesnika s bubrežnim zatajenjem. U istraživanju provedenom na 24 ispitanika koji nisu bili dijabetičari s normalnom funkcijom bubrega (ClCr> 80 ml / min), umjerenim oštećenjem bubrega (30-50 ml / min) i teškim oštećenjem bubrega (Upozorenja i mjere opreza).
Oštećenje jetre
Učinak oštećenja jetre na farmakokinetiku i farmakodinamiku Apidre nije proučen. Neke studije s ljudskim inzulinom pokazale su povećane razine inzulina u cirkulaciji u bolesnika s zatajenjem jetre. [Vidjeti Upozorenja i mjere opreza].
rod
Učinak spola na farmakokinetiku i farmakodinamiku Apidre nije proučen.
Trudnoća
Učinak trudnoće na farmakokinetiku i farmakodinamiku Apidre nije proučen.
Pušenje
Učinak pušenja na farmakokinetiku i farmakodinamiku Apidre nije proučen.
vrh
Neklinička toksikologija
Karcinogeneza, mutageneza, narušavanje plodnosti
Standardna dvogodišnja ispitivanja kancerogenosti na životinjama nisu provedena. U štakora Sprague Dawley, provedeno je 12-mjesečno ispitivanje toksičnosti za ponavljanje doze sa inzulinom glulisin u potkožnim dozama od 2,5, 5, 20 ili 50 jedinica / kg dva puta dnevno (doza rezultira izloženošću 1, 2, 8 i 20 puta prosječnom ljudskom dozom, ovisno o površini tijela usporedba).
Zabilježena je veća učestalost tumora mliječne žlijezde kod ženki štakora kojima je primijenjen glulisin inzulina u usporedbi s neliječenim kontrolama. Učestalost tumora mliječne žlijezde za inzulin glulisin i redoviti humani inzulin bila je slična. Značaj tih nalaza za ljude nije poznat. Inzulinski glulisin nije mutagena u sljedećim testovima: Amesov test, in vitro kromosom sisavaca test aberacije u stanicama kineskog hrčka V79, te in vivo mikronukleusni test eritrocita sisavaca u štakori.
U studijama plodnosti kod muških i ženskih štakora u potkožnim dozama do 10 jedinica / kg jednom dnevno (doza rezultira izlaganjem 2 puta većom od prosječnog čovjeka doza, na temelju usporedbe površine tijela), nisu postojali jasni štetni učinci na plodnost muškaraca i žena ili opće reproduktivne performanse životinja promatranom.
vrh
Kliničke studije
Sigurnost i djelotvornost Apidre proučavana je u odraslih bolesnika s dijabetesom tipa 1 i 2 (n = 1833) te u djece i adolescenata (4 do 17 godina) s dijabetesom tipa 1 (n = 572). Primarni parametar djelotvornosti u tim ispitivanjima bio je glikemijska kontrola, procijenjena korištenjem glikiranog hemoglobina (GHb je prijavljen kao HbA1c ekvivalent).
Dijabetes tipa 1 odrasli
Za bolesnike s dijabetesom tipa 1 provedena je randomizirana, otvorena studija s aktivnom kontrolom ne-inferiornosti u trajanju od 26 tjedana kako bi se procijenila sigurnost i djelotvornost Apidre (n = 339) u usporedbi s inzulinom lispro (n = 333), kada se daje supkutano u roku od 15 minuta prije obrok. Inzulin glargin je davan jednom dnevno u večernjim satima kao bazni inzulin. Postojalo je razdoblje od 4 tjedna s inzulinom lispro i inzulinom glarginom prije randomizacije. Većina bolesnika bila je kavkaška (97%). Pedeset osam posto pacijenata bili su muškarci. Srednja dob bila je 39 godina (raspon od 18 do 74 godine). Glikemijska kontrola, broj dnevnih injekcija inzulina kratkog djelovanja i ukupne dnevne doze Apidre i inzulina lispro bili su slični u dvije skupine liječenja (Tablica 6).
Tablica 6: dijabetes melitus tipa 1 - za odrasle
| Trajanje liječenja Liječenje u kombinaciji sa: |
26 tjedana Inzulinski glargin |
|
|---|---|---|
| Apidra® | Insulin Lispro | |
| ||
| Glicirani hemoglobin (GHb)* (%) | ||
| Broj pacijenata | 331 | 322 |
| Osnovna srednja vrijednost | 7.6 | 7.6 |
| Prilagođena srednja promjena od osnovne | -0.1 | -0.1 |
| Razlika u liječenju: Apidra - Insulin Lispro | 0.0 | |
| 95% CI za razliku u liječenju | (-0.1; 0.1) | |
| Bazalna doza inzulina (jedinica / dan) | ||
| Osnovna srednja vrijednost | 24 | 24 |
| Prilagođena srednja promjena od osnovne | 0 | 2 |
| Doza inzulina kratkog djelovanja (Jedinice dnevno) | ||
| Osnovna srednja vrijednost | 30 | 31 |
| Prilagođena srednja promjena od osnovne | -1 | -1 |
| Srednji broj injekcija inzulina kratkog djelovanja dnevno | 3 | 3 |
| Tjelesna težina (kg) | ||
| Osnovna srednja vrijednost | 73.9 | 74.1 |
| Srednja promjena od početne vrijednosti | 0.6 | 0.3 |
Dijabetes tipa 2 odrasli
Provedena je 26-tjedna, randomizirana, otvorena, aktivna kontrola, ne-inferiornost u bolesnika liječenih inzulinom s dijabetesom tipa 2 radi procjene sigurnost i djelotvornost Apidre (n = 435) koja se daje unutar 15 minuta prije obroka u odnosu na uobičajeni humani inzulin (n = 441) primijenjen 30 do 45 minuta prije obrok. NPH humani inzulin davan je dva puta dnevno kao bazni inzulin. Svi su pacijenti sudjelovali u razdoblju od 4 tjedna s redovitim ljudskim inzulinom i NPH ljudskim inzulinom. Osamdeset i pet posto bolesnika bilo je bijelaca, a 11% crnaca. Srednja dob bila je 58 godina (raspon od 26 do 84 godine). Prosječni indeks tjelesne mase (BMI) bio je 34,6 kg / m2. Nasumično, 58% pacijenata uzimalo je oralno antidijabetičko sredstvo. Ovi pacijenti su upućeni da nastave koristiti oralno antidijabetičko sredstvo u istoj dozi tijekom cijelog ispitivanja. Većina bolesnika (79%) pomiješala je inzulin kratkog djelovanja s ljudskim inzulinom NPH neposredno prije injekcije. Smanjenja od osnovne vrijednosti u GHb bila su slična između dvije skupine liječenja (vidjeti Tablicu 7). Nisu uočene razlike između Apidra i običnih humanih inzulinskih skupina u broju dnevnih injekcija inzulina kratkog djelovanja ili baznih ili kratkodjelujućih doza inzulina. (Vidi tablicu 7.)
Tablica 7: dijabetes melitus tipa 2 za odrasle
| Trajanje liječenja | 26 tjedana | |
|---|---|---|
| Liječenje u kombinaciji sa: | NPH humani inzulin | |
| Apidra® | Redoviti ljudski inzulin | |
| ||
| Glicirani hemoglobin (GHb)* (%) | ||
| Broj pacijenata | 404 | 403 |
| Osnovna srednja vrijednost | 7.6 | 7.5 |
| Prilagođena srednja promjena od osnovne | -0.5 | -0.3 |
| Razlika u liječenju: Apidra - redovni ljudski inzulin | -0.2 | |
| 95% CI za razliku u liječenju | (-0.3; -0.1) | |
| Bazalna doza inzulina (jedinica / dan) | ||
| Osnovna srednja vrijednost | 59 | 57 |
| Prilagođena srednja promjena od osnovne | 6 | 6 |
| Doza inzulina kratkog djelovanja (Jedinice dnevno) | ||
| Osnovna srednja vrijednost | 32 | 31 |
| Prilagođena srednja promjena od osnovne | 4 | 5 |
| Srednji broj injekcija inzulina kratkog djelovanja dnevno | 2 | 2 |
| Tjelesna težina (kg) | ||
| Osnovna srednja vrijednost | 100.5 | 99.2 |
| Srednja promjena od početne vrijednosti | 1.8 | 2.0 |
Dijabetes odraslih tipa 1: Prije i nakon obroka
Provedeno je 12-tjedno, randomizirano, otvoreno ispitivanje, aktivno kontrolirano, ne-inferiornost u bolesnika sa dijabetes tipa 1 za procjenu sigurnosti i djelotvornosti Apidre primijenjenog u različito vrijeme u odnosu na a obrok. Apidra je primijenjena subkutano ili 15 minuta prije obroka (n = 286) ili neposredno nakon prijema obrok (n = 296) i uobičajeni humani inzulin (n = 278) davani su supkutano 30 do 45 minuta prije obrok. Inzulin glargin primijenjen je jednom dnevno prije spavanja kao bazni inzulin. Uslijedilo je razdoblje od 4 tjedna s redovitim ljudskim inzulinom i inzulinom glargin praćeno randomizacijom. Većina bolesnika bila je kavkaška (94%). Srednja dob bila je 40 godina (raspon od 18 do 73 godine). Glikemijska kontrola (vidjeti tablicu 8) bila je usporediva za 3 režima liječenja. U ukupnom dnevnom broju injekcija inzulina kratkog djelovanja nisu primijećene promjene od početne vrijednosti liječenja. (Vidi tablicu 8.)
Tablica 8: Primjena prije i nakon jela kod dijabetesa melitusa tipa 1 kod odraslih
| Trajanje liječenja Liječenje u kombinaciji sa: |
12 tjedana inzulin glargin |
12 tjedana inzulin glargin |
12 tjedana inzulin glargin |
|---|---|---|---|
| Apidra® prije obroka |
Apidra® post obrok |
Redoviti ljudski inzulin | |
| |||
| Glicirani hemoglobin (GHb)* (%) | |||
| Broj pacijenata | 268 | 276 | 257 |
| Osnovna srednja vrijednost | 7.7 | 7.7 | 7.6 |
| Prilagođena srednja promjena od osnovne†| -0.3 | -0.1 | -0.1 |
| Bazalna doza inzulina (jedinica / dan) | |||
| Osnovna srednja vrijednost | 29 | 29 | 28 |
| Prilagođena srednja promjena od osnovne | 1 | 0 | 1 |
| Doza inzulina kratkog djelovanja (Jedinice dnevno) | |||
| Osnovna srednja vrijednost | 29 | 29 | 27 |
| Prilagođena srednja promjena od osnovne | -1 | -1 | 2 |
| Srednji broj injekcija inzulina kratkog djelovanja dnevno | 3 | 3 | 3 |
| Tjelesna težina (kg) | |||
| Osnovna srednja vrijednost | 79.2 | 80.3 | 78.9 |
| Srednja promjena od početne vrijednosti | 0.3 | -0.3 | 0.3 |
Pacijenti s dijabetesom tipa 1
Provedena je 26-tjedna, randomizirana, otvorena studija aktivne kontrole, ne-inferiornosti kod djece i adolescenata starijih od 4 godine s tipom 1 dijabetes melitus za procjenu sigurnosti i djelotvornosti Apidre (n = 277) u usporedbi s inzulinom lispro (n = 295), kada se daje supkutano u roku od 15 minuta prije obrok. Pacijenti su također primali inzulin glargin (primijenjen jednom dnevno navečer) ili NPH inzulin (primijenjen jednom ujutro i jedanput navečer). Prije randomizacije bilo je razdoblje od 4 tjedna s inzulinom lispro i inzulinom glarginom ili NPH-om. Većina bolesnika bila je kavkaška (91%). Pedeset posto pacijenata bili su muškarci. Srednja dob bila je 12,5 godina (raspon 4 do 17 godina). Srednji BMI bio je 20,6 kg / m2. Glikemijska kontrola (vidjeti tablicu 9) bila je usporediva za dva režima liječenja.
Tablica 9: Rezultati ispitivanja u 26 tjedana na pedijatrijskih bolesnika sa šećernom bolešću tipa 1
| Apidra® | lispro | |
|---|---|---|
| Broj pacijenata | 271 | 291 |
| Bazalni inzulin | NPH ili inzulinski glargin | NPH ili inzulinski glargin |
| ||
| Glicirani hemoglobin (GHb)* (%) | ||
| Osnovna srednja vrijednost | 8.2 | 8.2 |
| Prilagođena srednja promjena od osnovne | 0.1 | 0.2 |
| Razlika u liječenju: srednja vrijednost (95% -tni interval pouzdanosti) | -0.1 (-0.2, 0.1) | |
| Bazalna doza inzulina (jedinica / kg / dan) | ||
| Osnovna srednja vrijednost | 0.5 | 0.5 |
| Srednja promjena od početne vrijednosti | 0.0 | 0.0 |
| Doza inzulina kratkog djelovanja (Jedinice / kg / dan) | ||
| Osnovna srednja vrijednost | 0.5 | 0.5 |
| Srednja promjena od početne vrijednosti | 0.0 | 0.0 |
| Srednji broj injekcija inzulina kratkog djelovanja dnevno | 3 | 3 |
| Srednja osnovna tjelesna težina (kg) | 51.5 | 50.8 |
| Promjena srednje težine od početne (kg) | 2.2 | 2.2 |
Dijabetes tipa 1: odrasli: kontinuirana infuzijska infuzija inzulina
12-tjedna randomizirana, aktivna kontrolna studija (Apidra naspram inzulina aspart) provedena na odraslim osobama s dijabetesom tipa 1 (Apidra n = 29, inzulin aspart n = 30) procijenio je uporabu Apidre u vanjskom kontinuiranom potkožnom inzulinu pumpa. Svi su pacijenti bili bijelci. Srednja dob bila je 46 godina (raspon od 21 do 73 godine). Srednja vrijednost GHb povećala se od polazne do krajnje točke u obje skupine liječenja (sa 6,8% na 7,0% za Apidra; od 7,1% do 7,2% za inzulin aspart).
vrh
Način isporuke / skladištenja i rukovanje
Kako se opskrbljuje
| |
| Apidra 100 jedinica po mL (U-100) je dostupna kao: | |
| 10 ml bočice | NDC 0088-2500-33 |
| Sustav uložaka od 3 ml*, paket od 5 | NDC 0088-2500-52 |
| 3 ml SoloStar napunjena olovka, pakiranje od 5 | NDC 0088-2502-05 |
Igle za olovke nisu uključene u pakiranja.
Igle za olovke BD Ultra-Fine ™1 koje se koriste zajedno s OptiClikom prodaju se zasebno, a proizvode ih Becton Dickinson i Company.
Solostar je kompatibilan sa svim iglama olovaka Becton Dickinson and Company, Ypsomed i Owen Mumford.
skladištenje
Ne koristiti nakon isteka roka valjanosti (vidi kutiju i spremnik).
Neotvoreni sustav bočica / uložak / SoloStar
Neotvorene bočice Apidra, sustav uložaka i SoloStar čuvajte u hladnjaku (2 ° C-8 ° C), 36 ° F-46 ° F. Zaštiti od svjetlosti. Apidra ne treba čuvati u zamrzivaču i ne smije se smrzavati. Odbacite je ako je bila smrznuta.
Neotvorene bočice / sustavi uložaka / SoloStar koji se ne čuvaju u hladnjaku moraju se koristiti u roku od 28 dana.
Otvorena (tijekom upotrebe) bočica:
Otvorene bočice, neovisno o tome jesu li hladne ili ne, moraju se koristiti u roku od 28 dana. Ako hlađenje nije moguće, otvorena bočica u uporabi može se držati u hladnjaku do 28 dana daleko od izravne topline i svjetla, sve dok temperatura nije veća od 25 ° C.
Otvoreni (tijekom upotrebe) sustav uložaka:
Otvoreni (tijekom upotrebe) sustav uložaka umetnut u OptiClik® NE smije se hladiti, već ga treba držati ispod (25 ° C) ispod 77 ° F, daleko od direktne topline i svjetlosti. Otvoreni (u upotrebi) sustav uložaka mora se odbaciti nakon 28 dana. Ne čuvajte OptiClik®, sa ili bez sustava spremnika u hladnjaku, u bilo kojem trenutku.
Otvorena (upotrijebljena) SoloStar napunjena olovka:
Otvoreni SoloStar (koji je u upotrebi) NE MORAVE u hladnjak, već ga treba čuvati ispod (25 ° C) daleko od direktne topline i svjetlosti. Otvoreni (tijekom uporabe) SoloStar čuvan na sobnoj temperaturi mora se odbaciti nakon 28 dana.
Infuzijski setovi:
Infuzijske setove (rezervoari, cijevi i kateteri) i Apidra u rezervoaru treba odbaciti nakon 48 sati uporabe ili nakon izlaganja temperaturama koje prelaze 98,6 ° F (37 ° C).
Intravenska upotreba:
Infuzijske vrećice pripremljene kako je navedeno pod DOZIRANJE I UPRAVLJANJE su stabilne na sobnoj temperaturi 48 sati.
Priprema i rukovanje
Nakon razrjeđivanja za intravensku upotrebu, otopinu treba pregledati na čestice i promjenu boje prije primjene. Ne koristite otopinu ako je postala zamućena ili sadrži čestice; koristiti samo ako je bistra i bezbojna. Apidra nije kompatibilna s otopinom Dextrose i Ringers i, stoga, ne može se koristiti s ovim tekućinama. Primjena Apidre s drugim otopinama nije proučena i zbog toga se ne preporučuje.
Sustav uložaka: Ako OptiClik® (uređaj za dostavu inzulina za Apidru) ne radi, Apidra se može izvući iz sustava uloška u štrcaljku U-100 i ubrizgati.
Apidra, inzulinski glusin, podaci o pacijentu (na običnom engleskom)
zadnji put ažurirano: 02/2009
Detaljne informacije o znakovima, simptomima, uzrocima, liječenjima dijabetesa
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
natrag na: Pregledajte sve lijekove za dijabetes



