Starlix za liječenje dijabetesa
Naziv marke: Starlix
Generičko ime: tablete nateglinida
Sadržaj:
Opis
Klinička farmakologija
Kliničke studije
Indikacije i upotreba
kontraindikacije
Mjere opreza
Nuspojave
predoziranje
Doziranje i primjena
Kako se isporučuje
Starlix, nateglinid, potpune informacije o pacijentu (na običnom engleskom)
Opis
Starlix® (nateglinid) je oralni antidijabetički agens koji se koristi u liječenju šećerne bolesti tipa 2 [poznata i kao dijabetes melitus neovisan od inzulina (NIDDM) ili dijabetes koji nastaje kod odraslih]. Starlix, (-) - N - [(trans-4-izopropilcikloheksan) karbonil] -D-fenilalanin strukturno nije povezan sa oralnim sekretagogama sulfoniluree inzulina.
Strukturna formula je prikazana
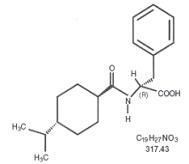
Nateglinid je bijeli prah molekulske težine 317,43. Slobodno je topiv u metanolu, etanolu i kloroformu, topiv u eteru, slabo topiv u acetonitrilu i oktanolu i praktično netopljiv u vodi. Starlix bikonveksne tablete sadrže 60 mg ili 120 mg nateglinida za oralnu primjenu.
Neaktivni sastojci: koloidni silicijev dioksid, natrij kroskarmeloza, hidroksipropil metilceluloza, željezovi oksidi (crveni ili žuta), laktoza monohidrat, magnezijev stearat, mikrokristalna celuloza, polietilen glikol, povidon, talk i titan dioksid.
vrh
Klinička farmakologija
Mehanizam djelovanja
Nateglinid je derivat aminokiseline koji snižava razinu glukoze u krvi stimulirajući izlučivanje inzulina iz gušterače. Ovo djelovanje ovisi o funkcioniranju beta-stanica na otočićima gušterače. Nateglinid stupa u interakciju s kalijumskim (K + ATP) kanal osjetljivim na beta-stanice pankreasa. Naknadna depolarizacija beta ćelije otvara kalcijev kanal, stvarajući priliv kalcija i izlučivanje inzulina. Opseg oslobađanja inzulina ovisi o glukozi i smanjuje se pri niskim razinama glukoze. Nateglinid je visoko tkivno selektivan s niskim afinitetom za srce i skeletne mišiće.
farmakokinetika
apsorpcija
Nakon oralne primjene neposredno prije obroka, nateglinid se brzo apsorbira s srednjim najvišim koncentracijama lijeka u plazmi (Cmax), koje se obično javljaju u roku od 1 sata (Tmax) nakon doziranja. Kada se primjenjuje na bolesnike s dijabetesom tipa 2 u rasponu doza od 60 mg do 240 mg tri puta dnevno za jedan tjedno, nateglinid je pokazao linearnu farmakokinetiku i za AUC (područje ispod krivulje koncentracije vrijeme / plazma) i Cmax. Otkriveno je i da je Tmax neovisan o dozi u ovoj populaciji bolesnika. Procjenjuje se da apsolutna bioraspoloživost iznosi oko 73%. Kada se daje sa ili nakon jela, na stupanj apsorpcije nateglinida (AUC) ostaje netaknuto. Međutim, dolazi do kašnjenja brzine apsorpcije karakteriziranog smanjenjem Cmax i odgode vremena do vršne koncentracije u plazmi (Tmax). Profili plazme karakteriziraju višestruki maksimumi koncentracije u plazmi kada se nateglinid daje u uvjetima gladovanja. Taj se učinak smanjuje kada se nateglinid uzima prije obroka.
Distribucija
Na temelju podataka nakon intravenskog (IV) davanja nateglinida, volumen raspodjele nateglinida u stanju dinamičke ravnoteže procjenjuje se na približno 10 litara kod zdravih ispitanika. Nateglinid se uveliko veže (98%) na proteine u serumu, prvenstveno na albumin u serumu i u manjoj mjeri Î ± 1 kiseli glikoprotein. Stupanj vezanja proteina u serumu neovisan je o koncentraciji lijeka u rasponu ispitivanja od 0,1-10 µg / mL.
Metabolizam
Nateglinid se metabolizira sustavom oksidaze mješovite funkcije prije uklanjanja. Glavni putevi metabolizma su hidroksilacija nakon čega slijedi konjugacija glukuronida. Glavni metaboliti su manje jaka antidijabetička sredstva nego nateglinid. Manji metabolit izoprena posjeduje jakost sličnu onoj matičnog spoja nateglinid.
In vitro podaci pokazuju da se nateglinid pretežno metabolizira citokrom P450 izoenzimima CYP2C9 (70%) i CYP3A4 (30%).
Izlučivanje
Nateglinid i njegovi metaboliti brzo se i potpuno eliminiraju nakon oralne primjene. U roku od 6 sati nakon doziranja, otprilike 75% primijenjenog 14C-nateglinida prikupljeno je u urinu. Osamdeset tri posto 14C-nateglinida izlučeno je mokraćom, a dodatnih 10% eliminirano je iz izmeta. Otprilike 16% 14C-nateglinida izlučeno je u urinu kao matični spoj. U svim ispitivanjima zdravih dobrovoljaca i bolesnika s dijabetesom tipa 2, koncentracije nateglinida u plazmi brzo su opale, s prosječnim poluživotom eliminacije od oko 1,5 sata. U skladu s ovim kratkim poluživotom eliminacije, nije bilo očiglednog nakupljanja nateglinida nakon višestrukog doziranja do 240 mg tri puta dnevno tijekom 7 dana.
Interakcije s lijekovima
Studije metabolizma in vitro pokazuju da se Starlix pretežno metabolizira citokrom P450 izozimom CYP2C9 (70%) i u manjoj mjeri CYP3A4 (30%). Starlix je potencijalni inhibitor izoenzima CYP2C9 in vivo, što pokazuje i njegova sposobnost inhibiranja in vitro metabolizma tolbutamida. Inhibicija metaboličkih reakcija CYP3A4 nije otkrivena u in vitro eksperimentima.
Glyburide: U randomiziranom unakrsnom ispitivanju s više doza, bili su bolesnici s dijabetesom tipa 2 davali 120 mg Starlixa tri puta dnevno prije jela 1 dan u kombinaciji s gliburidom 10 mg dnevno. Nije bilo klinički relevantnih promjena u farmakokinetikama bilo kojeg sredstva.
Metformin: Kad se Starlix 120 mg tri puta dnevno prije jela primjenjivao u kombinaciji s metforminom 500 mg tri puta dnevno pacijentima s dijabetesom tipa 2, nije bilo klinički važnih promjena ni u farmakokinetikama agent.
Digoksin: Kad se Starlix 120 mg prije obroka primjenjivao u kombinaciji s jednom dozom od 1 mg digoksina kod zdravih dobrovoljaca, nije bilo klinički važnih promjena ni u farmakokinetikama agent.
Warfarin: Kada su zdravi ispitanici davali Starlix 120 mg tri puta dnevno prije jela, tokom četiri dana kombinacija s jednom dozom 30 mg varfarina 2. dana, nije bilo promjena u farmakokinetikama nijednog od agent. Protrombinsko vrijeme nije utjecalo.
Diklofenak: Davanje jutarnjih i ručnih doza Starlixa 120 mg u kombinaciji s jednim 75 mg doza diklofenaka kod zdravih dobrovoljaca nije rezultirala značajnim promjenama u farmakokinetikama nijednog od njih agent.
Posebne populacije
Gerijatrijski: Starost nije utjecala na farmakokinetička svojstva nateglinida. Zbog toga nije potrebno prilagođavanje doze starijim pacijentima.
Spol: Nisu primijećene klinički značajne razlike u farmakokinetici nateglinida između muškaraca i žena. Stoga nije potrebno prilagođavanje doze temeljeno na spolu.
Rasa: Rezultati populacijske farmakokinetičke analize koja uključuje ispitanice kavkaskog, crnog i drugog etničkog podrijetla sugeriraju da rasa ima malo utjecaja na farmakokinetiku nateglinida.
Bubrežno oštećenje: U usporedbi sa zdravim podudarnim ispitanicima, bolesnici s dijabetesom tipa 2 i umjerena do teška bubrežna insuficijencija (CrCl 15-50 ml / min) koja nije na dijalizi prikazana je slično prividno klirens, AUC i Cmax. Pacijenti s dijabetesom tipa 2 i zatajivanjem bubrega na dijalizi su pokazali smanjenu ukupnu izloženost lijekovima. Međutim, bolesnici na hemodijalizi također su imali smanjenje vezivanja proteina u plazmi u usporedbi sa zdravim dobrovoljcima koji su se podudarali.
Oštećenje jetre: Najviša i ukupna izloženost nateglinida kod osoba s dijabetesom s blagom hepatičkom insuficijencijom povećana je za 30% u usporedbi sa zdravim pacijentima koji se podudaraju. Starlix® (nateglinid) treba primjenjivati s oprezom u bolesnika s kroničnom jetrom. (Pogledajte UPOZORENJE, Oštećenje jetre.)
farmakodinamiku
Starlix se brzo apsorbira i potiče lučenje inzulina gušterače u roku od 20 minuta od oralne primjene. Kada se Starlix dozira tri puta dnevno prije jela, naglo raste porast inzulina u plazmi, s najvišom razinom otprilike 1 sat nakon doziranja i padom na početnu vrijednost 4 sata nakon doziranja.
U dvostruko slijepom, kontroliranom kliničkom ispitivanju u kojem se Starlix primjenjivao prije svakog od tri obroci, razina glukoze u plazmi određena je tijekom 12-satnog dnevnog razdoblja nakon 7 tjedana tretman. Starlix se primjenjivao 10 minuta prije jela. Obroci su se temeljili na standardnim menijima za održavanje dijabetičke težine s ukupnim kalorijskim sadržajem na temelju visine svakog ispitanika. Starlix je proizveo statistički značajno smanjenje glikemije nakon posta i postprandijalne glikomije u usporedbi s placebom.
vrh
Kliničke studije
U devet dvostruko slijepih, placebo ili aktivno kontroliranih ispitivanja u trajanju od 8 do 24 tjedna randomizirano je 3.566 pacijenata kako bi se procijenila sigurnost i djelotvornost Starlix®-a (nateglinid). 3.513 bolesnika imalo je vrijednosti djelotvornosti izvan početnih vrijednosti. U tim se studijama Starlix primjenjivao do 30 minuta prije svakog od tri glavna obroka dnevno.
Starlix® monoterapija u usporedbi s placebom
U randomiziranom, dvostruko slijepom, placebo kontroliranom istraživanju, u trajanju od 24 tjedna, bolesnici s dijabetesom tipa 2 s HbA1C ‰ 8 6,8% samo na dijeti nasumično su primali Starlix (60 mg ili 120 mg tri puta dnevno prije jela) ili placebo. Polazna vrijednost HbA1C kretala se u rasponu od 7,9% do 8,1%, a 77,8% bolesnika prethodno se nije liječilo oralnom antidijabetičkom terapijom. Pacijenti prethodno liječeni antidijabetičkim lijekovima trebali su prekinuti taj lijek najmanje 2 mjeseca prije randomizacije. Dodavanje Starlixa prije obroka rezultiralo je statistički značajnim smanjenjem prosječnog HbA1C i srednjeg nivoa glukoze u plazmi (FPG) nakon posta (vidi tablicu 1). Smanjenja HbA1C i FPG bila su slična za pacijente koji su bili nai i oni koji su prethodno bili izloženi antidijabetičkim lijekovima.
U ovoj studiji prijavljena je jedna epizoda teške hipoglikemije (plazme glukoze <36 mg / dL) u bolesnika liječenih Starlixom 120 mg tri puta dnevno prije jela. Nijedan pacijent nije iskusio hipoglikemiju koja je zahtijevala pomoć treće strane. Pacijenti liječeni Starlixom imali su statistički značajno prosječno povećanje tjelesne težine u usporedbi s placebom (vidjeti tablicu 1).
U drugom randomiziranom, dvostruko slijepom, 24-tjednom, aktivnom i placebo kontroliranom ispitivanju, bolesnici s dijabetesom tipa 2 randomizirani su da primaju Starlix (120 mg tri puta dnevno prije jela), metformin 500 mg (tri puta dnevno), kombinacija Starlix 120 mg (tri puta dnevno prije obroka) i metformin 500 mg (tri puta dnevno), ili placebo. Osnovna vrijednost HbA1C kretala se u rasponu od 8,3% do 8,4%. Pedeset sedam posto pacijenata prethodno nije bilo liječeno oralnom antidijabetičkom terapijom. Starlix monoterapija rezultirala je značajnim smanjenjem prosječnog HbA1C i srednjeg FPG-a u usporedbi s placebom koji su bili slični rezultatima prethodnog ispitivanja (vidjeti tablicu 2).
Tablica 1: Rezultati krajnje točke za 24-tjedno ispitivanje fiksne doze Starlix® monoterapije
|
Placebo |
Starlix® 60 mg tri puta dnevno prije obroka |
Starlix® 120 mg tri puta dnevno prije obroka |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Polazna vrijednost (prosjek) | 8.0 | 7.9 | 8.1 |
| Promjena od početne (srednje) | +0.2 | -0.3 | -0.5 |
| Razlika od placeba (prosjek) | -0.5 | -0.7 | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Polazna vrijednost (prosjek) | 167.9 | 161.0 | 166.5 |
| Promjena od početne (srednje) | +9.1 | +0.4 | -4.5 |
| Razlika od placeba (prosjek) | -8.7 | -13.6 | |
| Težina (kg) | N = 170 | N = 169 | N = 166 |
| Polazna vrijednost (prosjek) | 85.8 | 83.7 | 86.3 |
| Promjena od početne (srednje) | -0.7 | +0.3 | +0.9 |
| Razlika od placeba (prosjek) | +1.0 | +1.6 |
p-vrijednost â € 0.004
Starlix® monoterapija u odnosu na druga oralna antidijabetička sredstva
gliburid
U 24-tjednom, dvostruko slijepom, aktivno kontroliranom ispitivanju, pacijenti s dijabetesom tipa 2 koji su bili na sulfonilureji â ¥ 3 mjeseca i koji imali su polaznu vrijednost HbA1C - 6,5% randomiziranih da su primili Starlix (60 mg ili 120 mg tri puta dnevno prije jela) ili gliburid 10 mg jednom dnevno. Pacijenti randomizirani u Starlix imali su značajno povećanje prosječnog HbA1C i srednjeg FPG-a u krajnjoj točki u usporedbi s bolesnicima randomiziranim u gliburid.
metformin
U drugom randomiziranom, dvostruko slijepom, 24-tjednom, aktivnom i placebo kontroliranom ispitivanju, bolesnici s dijabetesom tipa 2 randomizirani su da primaju Starlix (120 mg tri puta dnevno prije jela), metformin 500 mg (tri puta dnevno), kombinacija Starlix 120 mg (tri puta dnevno prije obroka) i metformin 500 mg (tri puta dnevno), ili placebo. Osnovna vrijednost HbA1C kretala se u rasponu od 8,3% do 8,4%. Pedeset sedam posto pacijenata prethodno nije bilo liječeno oralnom antidijabetičkom terapijom. Smanjenja prosječne HbA1C i srednje vrijednosti FPG u krajnjoj točki monoterapijom metforminom bila su značajno veća od smanjenja ovih varijabli sa Starlix monoterapijom (vidjeti tablicu 2). U odnosu na placebo, monoterapija Starlixom bila je povezana sa značajnim povećanjem prosječne težine, dok je monoterapija metforminom bila povezana sa značajnim smanjenjem srednje težine. Među podskupinom bolesnika koji prelaze na antidijabetičku terapiju, smanjenja prosječnog HbA1C i srednjeg FPG-a za Starlix monoterapiju bila su slična onima za monoterapiju metforminom (vidjeti tablicu 2). Među podskupinom bolesnika prethodno liječenih drugim antidijabetičkim lijekovima, prije svega gliburidom, HbA1C u Starlixu skupina za monoterapiju lagano se povećala od početne vrijednosti, dok je HbA1C smanjen u skupini za monoterapiju metforminom (vidjeti tablicu) 2).
Starlix® kombinirana terapija
metformin
U drugom randomiziranom, dvostruko slijepom, 24-tjednom, aktivnom i placebo kontroliranom ispitivanju, bolesnici s dijabetesom tipa 2 randomizirani su da primaju Starlix (120 mg tri puta dnevno prije jela), metformin 500 mg (tri puta dnevno), kombinacija Starlix 120 mg (tri puta dnevno prije obroka) i metformin 500 mg (tri puta dnevno), ili placebo. Osnovna vrijednost HbA1C kretala se u rasponu od 8,3% do 8,4%. Pedeset sedam posto pacijenata prethodno nije bilo liječeno oralnom antidijabetičkom terapijom. Pacijenti prethodno liječeni antidijabetičkim lijekovima morali su prekinuti lijek najmanje 2 mjeseca prije randomizacije. Kombinacija Starlixa i metformina rezultirala je statistički značajno većim smanjenjem HbA1C i FPG u usporedbi s monolixijom Starlixom ili metforminom (vidjeti tablicu 2). Starlix, sam ili u kombinaciji s metforminom, značajno je smanjio porast glukoze u prandialu od prije obroka do 2 sata nakon obroka u usporedbi s placebom i metforminom.
U ovoj studiji prijavljena je jedna epizoda teške hipoglikemije (plazme glukoze 36 mg / dl) u bolesnika koji su primali kombinacija Starlixa i metformina i četiri epizode teške hipoglikemije prijavljeni su kod jednog pacijenta u metforminu ruku za liječenje. Nijedan pacijent nije doživio epizodu hipoglikemije koja je zahtijevala pomoć treće strane. U usporedbi s placebom, Starlix monoterapija bila je povezana sa statistički značajnim povećanjem težine, dok nije primijećena značajna promjena u težini kod kombinirane terapije Starlixom i metforminom (vidjeti tablicu 2).
U sljedećem 24-tjednom, dvostruko slijepom, placebo kontroliranom ispitivanju, prvi put su uvedeni pacijenti s dijabetesom tipa 2 s HbA1C - 6,8% nakon liječenja metforminom (‰ mg 1500 mg dnevno tijekom ¥ ¥ 1 mjeseca). u razdoblje od četiri tjedna provedene monoterapije metforminom (2000 mg dnevno), a zatim je nasumično primljen Starlix (60 mg ili 120 mg tri puta dnevno prije jela) ili placebo, osim metformina. Kombinacija s Starlixom i metforminom bila je povezana sa statistički značajno većim smanjenjima u HbA1C u usporedbi s monoterapijom metforminom (-0,4% i -0,6% za Starlix 60 mg i Starlix 120 mg plus metformin, odnosno).
Tablica 2: Rezultati krajnje točke za 24-tjedno ispitivanje Starlix®monoterapije i kombinacije s metforminom
|
Placebo |
Starlix® 120 mg tri puta svaki dan prije jela |
metformin 500 mg tri puta dnevno |
Starlix® 120 mg prije obroci plus metformin * |
|
| HbA1C (%) | ||||
| svi | N = 160 | N = 171 | N = 172 | N = 162 |
| Polazna vrijednost (prosjek) | 8.3 | 8.3 | 8.4 | 8.4 |
| Promjena od početne (srednje) | +0.4 | -0.4 prije Krista | -0.8 c | -1.5 |
| Razlika od placeba | -0.8 | -1.2 | -1.9 | |
| Nan-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Polazna vrijednost (prosjek) | 8.2 | 8.1 | 8.3 | 8.2 |
| Promjena od početne (srednje) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Razlika od placeba | -1.0 | -1.1 | -1.9 | |
| Non-nan-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Polazna vrijednost (prosjek) | 8.3 | 8.5 | 8.7 | 8.7 |
| Promjena od početne (srednje) | +0.6 | +0.004 prije Krista | -0.8 c | -1.4 |
| Razlika od placeba | -0.6 | -1.4 | -2.0 | |
| FPG (mg / dL) | ||||
| svi | N = 166 | N = 173 | N = 174 | N = 167 |
| Polazna vrijednost (prosjek) | 194.0 | 196.5 | 196.0 | 197.7 |
| Promjena od početne (srednje) | +8.0 | -13.1 prije Krista | -30.0 c | -44.9 |
| Razlika od placeba | -21.1 | -38.0 | -52.9 | |
| Težina (kg) | ||||
| svi | N = 160 | N = 169 | N = 169 | N = 160 |
| Polazna vrijednost (prosjek) | 85.0 | 85.0 | 86.0 | 87.4 |
| Promjena od početne (srednje) | -0.4 | +0.9 prije Krista | -0.1 | +0.2 |
| Razlika od placeba | +1.3 | +0.3 | +0.6 |
p-vrijednost â ‰ ¤ 0,05 vs. placebo
b p-vrijednost â ¤ ¤ 0,03 vs. metformin
c p-vrijednost â ‰ ¤ 0,05 vs. kombinacija
* Metformin se primjenjivao tri puta dnevno
roziglitazona
Provedeno je 24-tjedno dvostruko slijepo multicentrično, placebo kontrolirano ispitivanje u bolesnika s tipom 2 dijabetes nije adekvatno kontroliran nakon terapijskog odgovora na monoterapiju rosiglitazonom 8 mg dnevno. Dodavanje Starlixa (120 mg tri puta dnevno uz obroke) povezano je sa statistički značajno većim smanjenjem HbA1C u usporedbi s monoterapijom rosiglitazonom. Razlika je iznosila -0,77% u 24 tjedna. Srednja promjena težine od početne vrijednosti iznosila je oko +3 kg za bolesnike liječene Starlix plus rosiglitazon u odnosu na oko 1 kg za bolesnike liječene placebom plus rosiglitazonom.
gliburid
U ispitivanju od 12 tjedana na pacijentima s dijabetesom tipa 2 koji nisu bili pod kontrolom glikurida 10 mg jednom dnevno, dodatak Starlixa (60 mg ili 120 mg tri puta dnevno prije jela) nije doveo do dodatnih korist.
vrh
Indikacije i upotreba
Starlix® (nateglinid) je indiciran kao dodatak prehrani i vježbanju radi poboljšanja kontrole glikemije u odraslih s dijabetesom melitusa tipa 2.
vrh
kontraindikacije
Starlix® (nateglinid) je kontraindiciran bolesnicima sa:
1. Poznata preosjetljivost na lijek ili njegove neaktivne sastojke.
2. Dijabetes tipa 1.
3. Dijabetička ketoacidoza. Ovo stanje treba liječiti inzulinom.
vrh
Mjere opreza
Makrovaskularni ishodi: Nema kliničkih studija koje bi utvrdile konačne dokaze o smanjenju makrovaskularnog rizika sa Starlixom ili bilo kojim drugim antidijabetičkim lijekom.
Hipoglikemija: Svi oralni lijekovi za snižavanje glukoze u krvi koji se sistemski apsorbiraju mogu proizvesti hipoglikemiju. Učestalost hipoglikemije povezana je s težinom dijabetesa, razinom kontrole glikemije i drugim karakteristikama bolesnika. Gerijatrijski bolesnici, neuhranjeni i oni s insuficijencijom nadbubrežne ili hipofize ili ozbiljnim oštećenjem bubrega osjetljiviji su na učinak smanjenja glukoze ovih tretmana. Rizik od hipoglikemije može se povećati napornim tjelesnim vježbanjem, gutanjem alkohola, nedovoljan unos kalorija na akutnoj ili kroničnoj osnovi ili kombinacije s drugim oralnim antidijabeticima agenti. Hipoglikemiju može biti teško prepoznati u bolesnika s autonomnom neuropatijom i / ili onih koji koriste beta blokatore. Starlix® (nateglinid) treba davati prije jela kako bi se smanjio rizik od hipoglikemije. Pacijenti koji preskaču obroke također bi trebali preskočiti svoju zakazanu dozu Starlixa kako bi smanjili rizik od hipoglikemije.
Oštećenje jetre: Starlix treba primjenjivati s oprezom u bolesnika s umjerenom do teškom bolešću jetre, jer takvi bolesnici nisu proučavani.
Gubitak kontrole glikemije
Prolazni gubitak kontrole glikemije može se dogoditi s vrućicom, infekcijom, traumom ili operacijom. Terapija inzulinom može biti potrebna umjesto terapije Starlixom u takvim vremenima. Može se pojaviti sekundarno zatajenje ili smanjena učinkovitost Starlixa tijekom određenog vremenskog razdoblja.
Informacije za pacijente
Bolesnike treba obavijestiti o potencijalnim rizicima i prednostima Starlix-a i alternativnim načinima terapije. Treba objasniti rizike i upravljanje hipoglikemijom. Pacijente treba uputiti da uzimaju Starlix 1 do 30 minuta prije gutanja obroka, ali da preskoče njihovu predviđenu dozu ako preskoče obrok kako bi se smanjio rizik od hipoglikemije. O interakcijama lijekova treba razgovarati s pacijentima. Pacijente treba obavijestiti o mogućim interakcijama lijeka i lijeka sa Starlixom.
Laboratorijska ispitivanja
Odgovor na terapije treba povremeno ocjenjivati vrijednostima glukoze i razinama HbA1C.
Interakcije s lijekovima
Nateglinid se vrlo veže na proteine u plazmi (98%), uglavnom na albumin. Ispitivanja in vitro raseljavanja s lijekovima koji se vežu za proteine poput furosemida, propranolola, kaptoprila, nikardipina, pravastatina, gliburid, varfarin, fenitoin, acetilsalicilna kiselina, tolbutamid i metformin nisu pokazali utjecaj na opseg nateglinidnog proteina obvezujući. Slično tome, nateglinid nije imao utjecaja na vezanje propranolola, gliburida, nikardipina, varfarina, fenitoina, acetilsalicilne kiseline i tolbutamida in vitro. Međutim, razborito ocjenjivanje pojedinačnih slučajeva opravdano je u kliničkim uvjetima.
Određeni lijekovi, uključujući nesteroidne protuupalne agense (NSAID), salicilate, inhibitore monoamin oksidaze i neselektivni agensi koji blokiraju beta adrenergiku mogu potencirati hipoglikemijsko djelovanje Starlixa i drugih oralnih antidijabetičara lijekovi.
Određeni lijekovi, uključujući tiazide, kortikosteroide, proizvode štitnjače i simpatomimetike, mogu smanjiti hipoglikemijsko djelovanje Starlix-a i drugih oralnih antidijabetičkih lijekova.
Kada se ovi lijekovi daju ili odustanu od pacijenata koji primaju Starlix, pacijenta treba pomno promatrati radi promjene u glikemijskoj kontroli.
Interakcije lijekova / hrane
Na farmakokinetiku nateglinida nije utjecao sastav obroka (visokih proteina, masti ili ugljikohidrata). Međutim, maksimalna razina u plazmi značajno je smanjena kada je Starlix primijenjen 10 minuta prije tekućeg obroka. Starlix nije imao utjecaja na pražnjenje želuca kod zdravih ispitanika, što je ocijenjeno ispitivanjem acetaminofenom.
Kancerogeneza / mutageneza / oslabljivanje plodnosti
Kancerogenost: Provedeno je dvogodišnje istraživanje kancerogenosti na štakorima Sprague-Dawley s oralnim dozama nateglinida do 900 mg / kg / dan, što je rezultiralo izloženošću AUC-om u mužjaka i ženki štakora otprilike 30 i 40 puta više od terapeutske izloženosti ljudi, s preporučenom dozom Starlix od 120 mg, tri puta dnevno prije obroka. Provedeno je dvogodišnje istraživanje kancerogenosti na miševima B6C3F1 oralnim dozama nateglinida do 400 mg / kg / dan, što je rezultiralo izloženošću AUC-a kod muškaraca i ženke miševa otprilike 10 i 30 puta više od terapeutske izloženosti čovjeka s preporučenom dozom Starlix od 120 mg, tri puta dnevno prije jela. Nisu pronađeni dokazi o tumorskom odgovoru ni kod štakora ni kod miševa.
Mutageneza: Nateglinid nije bio genotoksičan u in vitro Ames testu, ispitivanju limfoma mišjeg testa, testu aberacije kromosoma u stanicama pluća kineskog hrčka ili u in vivo testu na mikronukleusu miša.
Oštećenje plodnosti: Davanje nateglinida štakorima na plodnost nije utjecalo u dozama do 600 mg / kg (otprilike 16 puta veća od terapijske izloženosti ljudi s preporučenom dozom Starlix od 120 mg tri puta dnevno prije jela).
Trudnoća
Trudnoća Kategorija C
Nateglinid nije bio teratogen na štakorima u dozama do 1000 mg / kg (otprilike 60 puta više od terapijske izloženosti ljudi s preporučenom dozom Starlix od 120 mg, tri puta dnevno prije jela). Kod kunića je na embrionalni razvoj negativno utjecalo i učestalost žučnog mjehura ili malog žučnog mjehura povećana u doza od 500 mg / kg (otprilike 40 puta veća od terapijske izloženosti ljudi s preporučenom dozom Starlix od 120 mg, tri puta dnevno prije jela). Ne postoje odgovarajuća i dobro kontrolirana ispitivanja na trudnicama. Starlix se ne smije koristiti tijekom trudnoće.
Rad i dostava
Učinak Starlixa na porođaj i porođaj kod ljudi nije poznat.
Negovateljice
Studije na dojećim štakorima pokazale su da se nateglinid izlučuje u mlijeku; omjer AUC0-48h u mlijeku i plazmi bio je otprilike 1: 4. Tijekom peri- i postnatalnog razdoblja tjelesna težina bila je manja u potomstvu štakora koji su davali nateglinid u 1000 mg / kg (približno 60 puta veća od terapijske izloženosti ljudi s preporučenom dozom Starlix od 120 mg, tri puta dnevno prije jela). Nije poznato izlučuje li se Starlix u majčino mlijeko. Budući da se mnogi lijekovi izlučuju u majčino mlijeko, Starlix se ne smije davati dojiljama.
Dječja upotreba
Sigurnost i učinkovitost Starlixa u pedijatrijskih bolesnika nisu utvrđene.
Gerijatrijska upotreba
Nisu primijećene razlike u sigurnosti ili djelotvornosti Starlixa između pacijenata starijih od 65 godina i onih mlađih od 65 godina. Međutim, veća osjetljivost nekih starijih osoba na Starlix terapiju ne može se isključiti.
vrh
Nuspojave
U kliničkim ispitivanjima, oko 2600 bolesnika s dijabetesom tipa 2 liječeno je Starlix® (nateglinidom). Od toga otprilike 1.335 bolesnika liječeno je 6 mjeseci ili duže, a otprilike 190 pacijenata tijekom jedne godine ili duže.
Hipoglikemija je bila relativno neuobičajena u svim kliničkim ispitivanjima. Samo 0,3% Starlixovih bolesnika prekinulo je hipoglikemiju. Gastrointestinalni simptomi, posebno proljev i mučnina, nisu bili češći u bolesnika koji su koristili kombinaciju Starlixa i metformina nego u bolesnika koji su primali samo metformin. Isto tako, periferni edem nije bio češći kod bolesnika koji su koristili kombinaciju Starlixa i rosiglitazona nego u bolesnika koji su primali samo rosiglitazon. Sljedeća tablica navodi događaje koji su se javljali češće kod Starlixovih bolesnika nego placebo bolesnici u kontroliranim kliničkim ispitivanjima.
Najčešći neželjeni događaji (‰% 2% u Starlix® pacijenata) u ispitivanjima monolixa Starlix® (% bolesnika)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Preferirani termin | ||
| Gornja respiratorna infekcija | 8.1 | 10.5 |
| Bol u leđima | 3.7 | 4.0 |
| Simptomi gripe | 2.6 | 3.6 |
| Vrtoglavica | 2.2 | 3.6 |
| artropatija | 2.2 | 3.3 |
| Proljev | 3.1 | 3.2 |
| Slučajna trauma | 1.7 | 2.9 |
| Bronhitis | 2.6 | 2.7 |
| Kašalj | 2.2 | 2.4 |
| Hipoglikemija | 0.4 | 2.4 |
Tijekom iskustva nakon stavljanja lijeka u promet, zabilježeni su rijetki slučajevi reakcija preosjetljivosti, kao što su osip, svrbež i urtikarija. Slično, zabilježeni su slučajevi žutice, kolestatskog hepatitisa i povišene vrijednosti jetrenih enzima.
Abnormalnosti u laboratoriju
Urična kiselina: Povećana je prosječna razina mokraćne kiseline za bolesnike liječene samo Starlixom, Starlixom u kombinaciji s metforminom, samim metforminom i samo gliburidom. Odgovarajuće razlike od placeba bile su 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL i 0,19 mg / dL. Klinički značaj ovih nalaza nije poznat.
vrh
predoziranje
U kliničkoj studiji bolesnika sa dijabetesom tipa 2 primijenjen je Starlix® (nateglinid) povećavajući doze do 720 mg dnevno tijekom 7 dana i nije bilo klinički značajnih štetnih događaja prijavljen. U kliničkim ispitivanjima nije bilo slučajeva predoziranja Starlixom. Međutim, predoziranje može rezultirati pretjeranim učinkom snižavanja glukoze s razvojem hipoglikemijskih simptoma. Hipoglikemijske simptome bez gubitka svijesti ili neuroloških nalaza treba liječiti oralnom glukozom i prilagodbama uzoraka doziranja i / ili obroka. Teške hipoglikemijske reakcije s komom, napadajem ili drugim neurološkim simptomima trebaju se liječiti intravenskom glukozom. Kako je nateglinid visoko vezan za proteine, dijaliza nije učinkovito sredstvo za njegovo uklanjanje iz krvi.
vrh
Doziranje i primjena
Starlix® (nateglinid) treba uzimati 1 do 30 minuta prije jela.
Monoterapija i kombinacija s metforminom ili tiazolidindionom
Preporučena početna i održavajuća doza Starlixa, sama ili u kombinaciji s metforminom ili tiazolidindionom, je 120 mg tri puta dnevno prije jela.
Doza od 60 mg Starlixa, sama ili u kombinaciji s metforminom ili tiazolidindionom, može se primijeniti u bolesnika koji su blizu cilja HbA1C kada se započne s liječenjem.
Doziranje u gerijatrijskih bolesnika
Obično nisu potrebna prilagođavanja doze. Međutim, veća osjetljivost nekih osoba na Starlix terapiju ne može se isključiti.
Doziranje kod oštećenja bubrega i jetre
Nije potrebno prilagođavanje doze u bolesnika s blagom do teškom bubrežnom insuficijencijom ili u bolesnika s blagom hepatičkom insuficijencijom. Doziranje bolesnika s umjerenom do teškom disfunkcijom jetre nije proučeno. Stoga se Starlix treba primjenjivati s oprezom u bolesnika s umjerenom do teškom bolešću jetre (vidjeti UPOZORENJE, Oštećenje jetre).
vrh
Kako se isporučuje
Starlix® (nateglinid) tablete
60 mg
Ružičasta, okrugla tableta s iverziranim rubom s naljepnicom "Starlix" s jedne strane i "60" na drugoj.
Boce od 100... NDC 0078-0351-05
120 mg
Žuta, ovaloidna tableta s oznakom "Starlix" na jednoj je strani uklesana i "120" na drugoj.
Boce od 100... NDC 0078-0352-05
skladištenje
Čuvati na 25 ° C; izleti dopušteni na 15 ºC-30 ºC (59 ºF-86 ºF).
Stavite u usku posudu, USP.
T2008-01
REV: SRPANJA 2008
Proizveo:
Novartis Pharma Stein AG
Stein, Švicarska
Distribuira:
Novartis Pharmaceuticals Corporation
Istočni Hanover, New Jersey 07936
© Novartis
Ažurirano 07/2008
Starlix, nateglinid, potpune informacije o pacijentu (na običnom engleskom)
Detaljne informacije o znakovima, simptomima, uzrocima, liječenjima dijabetesa
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
natrag na: Pregledajte sve lijekove za dijabetes



