Iloperidon (fanapt) Potpune informacije o propisivanju
Naziv marke: Fanapt
Generičko ime: Iloperidon
Vodič za propisivanje Fanapt (Iloperidon) (PDF)
Sadržaj:
Boksano upozorenje
Indikacije i upotreba
Doziranje i primjena
kontraindikacije
Upozorenja i mjere opreza
Nuspojave
Interakcije s lijekovima
Upotreba u određenoj populaciji
Zlouporaba droga i ovisnost
Predozirati
Opis
Klinička farmakologija
Neklinička toksikologija
Kliničke studije
Kako se isporučuje
Vodič za lijekove Brintellix
UPOZORENJE: POVEĆANA MORTALNOST U STARIM BOLESNICIMA SA DIHEZIJSKOM PSIHOSOM
Stariji bolesnici s psihozom povezanom sa demencijom liječeni antipsihoticima povećani su rizik od smrti. FANAPT nije odobren za liječenje bolesnika s demencijom povezanom sa demencijom.
Indikacije i upotreba
FANAPT® je indiciran za liječenje shizofrenije u odraslih.
Prilikom odlučivanja među alternativnim tretmanima koji su dostupni za ovo stanje, liječnik koji uzima liječnika treba uzeti u obzir nalaz da je FANAPT povezan s produženjem intervala QTc. Produljenje intervala QTc povezano je s nekim drugim lijekovima sa sposobnošću izazivanja torsade de aritmija tipa pointes, potencijalno fatalna polimorfna ventrikularna tahikardija koja može rezultirati iznenadnim smrt. U mnogim slučajevima to bi dovelo do zaključka da je prvo treba probati druge lijekove. Hoće li FANAPT izazvati torsade de pointes ili povećati brzinu nagle smrti još nije poznato.
Bolesnicima se mora titrirati do učinkovite doze FANAPT-a. Dakle, kontrola simptoma može se odgoditi tijekom prvih 1 do 2 tjedna liječenja u usporedbi s nekim drugim antipsihoticima koji ne zahtijevaju sličnu titraciju. Propisivači trebaju imati na umu ovo kašnjenje prilikom odabira antipsihotičkog lijeka za liječenje shizofrenije.
nastavi priču u nastavku
Doziranje i primjena
Uobičajena doza
FANAPT mora biti titriran polako od niske početne doze kako bi se izbjegla ortostatska hipotenzija zbog njegovih alfa-adrenergičkih svojstava blokiranja. Preporučena početna doza za FANAPT tablete je 1 mg oralno dva puta dnevno. Povećanja doze kako bi se dostigao ciljni raspon od 6 -12 mg dva puta dnevno (12_24 mg / dan) mogu se izvesti s dnevnim prilagođavanjem doze koja ne prelazi 2 mg dva puta dnevno (4 mg / dan). Maksimalna preporučena doza je 12 mg dva puta dnevno (24 mg / dan). Doze FANAPT-a iznad 24 mg / dan nisu sustavno ocjenjene u kliničkim ispitivanjima. Učinkovitost je dokazana s FANAPT u rasponu doza od 6 do 12 mg dva puta dnevno. Propisivači trebaju imati na umu činjenicu da pacijentima treba titrirati do učinkovite doze FANAPT-a. Dakle, kontrola simptoma može se odgoditi tijekom prvih 1 do 2 tjedna liječenja u usporedbi s nekim drugim antipsihoticima koji ne zahtijevaju sličnu titraciju. Propisnici također trebaju biti svjesni da su neki štetni učinci povezani s primjenom FANAPT-a povezani s dozom. FANAPT se može davati bez obzira na obroke.
Doziranje u posebnim populacijama
Prilagodba doze za pacijente koji uzimaju FANAPT istodobno s potencijalnim inhibitorima CYP2D6: Doza FANAPT treba biti smanjuje se za jednu polovinu ako se primjenjuju istodobno s jakim inhibitorima CYP2D6, kao što su fluoksetin ili paroksetin. Kad se inhibitor CYP2D6 povuče iz kombinirane terapije, dozu FANAPT-a tada treba povećati na mjesto gdje je ranije bio.
Prilagodba doze za pacijente koji uzimaju FANAPT istodobno s potencijalnim inhibitorima CYP3A4: FANAPT doza treba biti smanjuje se za jednu polovinu ako se primjenjuju istodobno s jakim inhibitorima CYP3A4, poput ketokonazola ili klaritromicin. Kada se inhibitor CYP3A4 povuče iz kombinirane terapije, dozu FANAPT-a treba povećati na mjestu gdje je ranije bio.
Prilagodba doze za bolesnike koji uzimaju FANAPT koji su metabolizatori CYP2D6: FANAPT dozu treba smanjiti za polovicu kod loših metabolizatora CYP2D6.
Oštećenje jetre: Nije potrebno prilagođavanje doze FANAPT-u u bolesnika s blagim oštećenjem jetre. Pacijenti s umjerenim oštećenjem jetre mogu zahtijevati smanjenje doze, ako je klinički indicirano. FANAPT se ne preporučuje pacijentima s ozbiljnim oštećenjem jetre.
Liječenje održavanja
U dugoročnijoj studiji, FANAPT je bio učinkovit u odgađanju vremena ponovne pojave u bolesnika sa shizofrenijom koji su bili stabilizirani na FANAPT do 24 mg / dan. Pacijente treba povremeno preispitivati kako bi se utvrdila potreba za liječenjem.
Ponovno je obustavljeno liječenje u bolesnika iako nema podataka koji bi se posebno bavili ponovnim liječenjem liječenja, preporučuje se pridržavati se rasporeda titracije započetog kad god su pacijenti imali interval više FANAPT-a nego 3 dana.
vrh
Oblici i snage lijeka
FANAPT tablete dostupne su u sljedećim jakostima: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg i 12 mg. Tablete su bijele, okrugle, ravne, iskrivljene i označene su s logotipom "" s utisnutim s jedne strane i s jačinom tableta "1", "2", "4", "6", "8", "10", ili "12" utisnuto s druge strane.
vrh
kontraindikacije
FANAPT je kontraindiciran kod osoba s poznatom reakcijom preosjetljivosti na proizvod. Zabilježeni su anafilaksija, angioedem i druge reakcije preosjetljivosti.
vrh
UPOZORENJA I UPOZORENJE
Povećana smrtnost starijih bolesnika sa psihozom povezanom sa demencijom
Antipsihotici povećavaju sveukupni rizik od smrti u starijih bolesnika s psihozom povezanom sa demencijom. Analize 17 ispitivanja demencije povezane s demencijom placebom kontroliranih ispitivanja (modalno trajanje od 10 tjedana i uglavnom kod pacijenata koji su uzimali atipične antipsihotički lijekovi) otkrili su rizik smrti u bolesnika liječenih između 1,6 i 1,7 puta nego u bolesnika liječenih placebom. Tijekom tipičnog kontroliranog ispitivanja od 10 tjedana stopa smrti u bolesnika liječenih lijekovima iznosila je oko 4,5%, u usporedbi sa stopom od oko 2,6% u bolesnika liječenih placebom.
Iako su uzroci smrti različiti, činilo se da je većina smrti kardiovaskularna (npr. Zatajenje srca, iznenadna smrt) ili infektivna (npr. Upala pluća). FANAPT nije odobren za liječenje bolesnika s demencijom povezanom sa demencijom.
Cerebrovaskularne neželjene reakcije, uključujući moždani udar, u starijih bolesnika sa demencijom povezanom s psihozom
U pokusima kontroliranim placebom u starijih osoba s demencijom, pacijenti randomizirani u risperidon, aripiprazol i olanzapin imali su veću učestalost moždanog udara i prolaznog ishemijskog napada, uključujući fatalni udar. FANAPT nije odobren za liječenje bolesnika s demencijom povezanom sa demencijom.
Produženje QT-a
U otvorenoj QTc studiji u bolesnika sa shizofrenijom ili shizofaktivnim poremećajem (n = 160), FANAPT je povezan s produženjem QTc za 9 msec uz dozu iloperidona od 12 mg dva puta dnevno. Učinak FANAPT-a na QT interval pojačan je prisutnošću metaboličke inhibicije CYP450 2D6 ili 3A4 (paroksetin 20 mg jednom dnevno i ketokonazol 200 mg dva puta dnevno). U uvjetima inhibicije metabolizma i za 2D6 i za 3A4, FANAPT 12 mg dva puta dnevno povezan je s prosječnim porastom QTcF od početne vrijednosti od oko 19 msec.
Nisu zabilježeni slučajevi torsade de pointes ili drugih teških srčanih aritmija tijekom kliničkog programa prije stavljanja na tržište.
Upotrebu FANAPT-a treba izbjegavati u kombinaciji s drugim lijekovima za koje se zna da produžuje QTc, uključujući klasu 1A (npr. Kinidin, prokainamid) ili antiaritmički lijekovi, antipsihotici (npr. klorpromazin, tioridazin), antibiotici klase III (npr. amiodaron, sotalol), antibiotici (npr. gatifloksacin, moksifloksacin) ili bilo koji drugi razred lijekova za koji se zna da produžuje interval QTc (npr. pentamidin, levomethalacetat, metadon). FANAPT treba izbjegavati i u bolesnika s kongenitalnim dugim QT sindromom i u bolesnika s srčanom aritmijom u povijesti.
Izvjesne okolnosti mogu povećati rizik od torsade de pointes i / ili iznenadne smrti povezane s primjenom lijekova koji produljuju QTc interval, uključujući (1) bradikardiju; (2) hipokalemija ili hipomagnezimija; (3) istodobna primjena drugih lijekova koji produljuju interval QTc; i (4) prisutnost urođenog produženja QT intervala; (5) nedavni akutni infarkt miokarda; i / ili (6) nekompenziranog zatajenja srca.
Potreban je oprez prilikom propisivanja FANAPT-a s lijekovima koji inhibiraju metabolizam FANAPT-a i u bolesnika sa smanjenom aktivnošću CYP2D6.
Preporučuje se pacijentima koji se razmatraju za liječenje FANAPT-om, a koji su pod rizikom da budu značajni poremećaji elektrolita imaju početna mjerenja kalija i magnezija u serumu s periodičnim mjerenjima praćenja. Hipokalemija (i / ili hipomagnezimija) može povećati rizik od produženja QT i aritmije. FANAPT treba izbjegavati u bolesnika s poviješću značajnih kardiovaskularnih bolesti, npr. QT produženje, nedavni akutni infarkt miokarda, kompenzirano zatajenje srca ili srčana aritmija. FANAPT treba prekinuti u bolesnika za koje je ustanovljeno da imaju trajna mjerenja QTc> 500 msec.
Ako pacijenti koji uzimaju FANAPT imaju simptome koji mogu ukazivati na pojavu srčanih aritmija, npr. vrtoglavica, palpitacije ili sinkopa, liječnik koji propisuje lijek trebao bi započeti daljnju procjenu, uključujući srčanu praćenja.
Neuroleptički maligni sindrom (NMS)
Zabilježen je potencijalno fatalan simptomski kompleks koji se ponekad naziva i neuroleptički maligni sindrom (NMS) zajedno s primjenom antipsihotičkih lijekova, uključujući FANAPT. Kliničke manifestacije uključuju hiperpireksiju, rigidnost mišića, izmijenjen mentalni status (uključujući katatonične znakove) i dokaz autonomne nestabilnosti (nepravilan puls ili krvni tlak, tahikardija, dijaforeza i srčana aritmije). Dodatni znakovi mogu uključivati povišenu kreatin fosfokinazu, mioglobinuriju (rabdomiolizu) i akutno zatajenje bubrega. Dijagnostička procjena bolesnika s ovim sindromom je komplicirana. Kad se dolazi do dijagnoze, važno je identificirati slučajeve u koje klinička slika uključuje kako ozbiljne medicinske bolesti, tako i neliječenih ili neadekvatno liječenih ekstrapiramidnih znakova i simptoma (EPS). Ostala važna razmatranja u diferencijalnoj dijagnozi uključuju centralnu antikolinergičku toksičnost, toplotni udar, groznicu lijekova i patologiju primarnog središnjeg živčanog sustava (CNS).
Upravljanje ovim sindromom mora uključivati: (1) trenutno prekid antipsihotičkih lijekova i drugih lijekova koji nisu bitni za istodobnu terapiju, (2) intenzivno simptomatsko liječenje i medicinski nadzor, i (3) liječenje svih istodobnih ozbiljnih medicinskih problema za koje su dostupni posebni tretmani. Ne postoji opći dogovor o specifičnim režimima farmakološkog liječenja za NMS.
Ako pacijent nakon oporavka od NMS-a zahtijeva liječenje antipsihoticima, potrebno je pažljivo razmotriti potencijalno ponovno uvođenje lijekova. Pacijenta treba pomno nadzirati, jer su zabilježeni recidivi NMS-a.
Tardivna diskinezija
Tardivna diskinezija je sindrom koji se sastoji od potencijalno nepovratnih, nehotičnih, diskinetičkih pokreta, koji se mogu razviti u bolesnika liječenih antipsihoticima. Iako se čini da je prevalenca sindroma najveća među starijim osobama, posebno starijim ženama, to je nemoguće oslanjaju se na procjene učestalosti predviđanja za početak antipsihotičkog liječenja, za koje će se pacijenti vjerojatno razviti sindrom. Razlikuju li se antipsihotički lijekovi u potencijalima da izazovu tardivnu diskineziju.
Vjeruje se rizik od razvoja tardivne diskinezije i vjerojatnost da će postati nepovratna povećati kao trajanje liječenja i ukupnu kumulativnu dozu primijenjenog antipsihotika povećava. Međutim, sindrom se može razviti, iako mnogo rjeđe, nakon relativno kratkih razdoblja liječenja malim dozama.
Ne postoji poznato liječenje utvrđenih slučajeva tardivne diskinezije, iako se sindrom može povući, djelomično ili u potpunosti, ako se antipsihotički tretman povuče. Međutim, sam antipsihotički tretman može suzbiti (ili djelomično suzbiti) znakove i simptome sindroma i na taj način možda maskirati temeljni proces. Učinak koji simptomatska supresija ima na dugoročni tijek sindroma nije poznat.
S obzirom na ta razmatranja, FANAPT treba propisati na način koji najvjerojatnije smanjuje pojavu tardivne diskinezije. Kronični antipsihotički tretman uglavnom bi trebao biti rezerviran za pacijente koji pate od kronične bolesti na koju je poznato da (1) reagira antipsihotici i (2) za koje nisu dostupni alternativni, jednako učinkoviti, ali potencijalno manje štetni tretmani ili prikladno. U bolesnika koji zahtijevaju kronično liječenje, potrebno je tražiti najmanju dozu i najkraće trajanje liječenja koje daju zadovoljavajući klinički odgovor. Potreba za nastavkom liječenja treba povremeno preispitivati.
Ako se kod pacijenta na FANAPT-u pojave znakovi i simptomi tardivne diskinezije, potrebno je razmotriti prekid liječenja. Međutim, neki pacijenti mogu zahtijevati liječenje FANAPT-om unatoč prisutnosti sindroma.
Metaboličke promjene
Atipični antipsihotički lijekovi povezani su s metaboličkim promjenama koje mogu povećati kardiovaskularni / cerebrovaskularni rizik. Te metaboličke promjene uključuju hiperglikemiju, dislipidemiju i povećanje tjelesne težine. Iako se pokazalo da svi atipični antipsihotički lijekovi proizvode neke metaboličke promjene, svaki lijek u klasi ima svoj specifični profil rizika.
Hiperglikemija i dijabetes melitus
Zabilježena je hiperglikemija, u nekim slučajevima ekstremna i povezana s ketoacidozom ili hiperosmolarnom komom ili smrću, u bolesnika liječenih atipičnim antipsihoticima, uključujući FANAPT. Procjena odnosa između atipične primjene antipsihotika i abnormalnosti glukoze komplicirana je mogućnošću povećanja pozadinski rizik od dijabetes melitusa u bolesnika sa shizofrenijom i sve veća učestalost šećerne bolesti općenito populacija. S obzirom na ove zbrke, odnos između atipičnih antipsihotičkih primjena i nuspojava povezanih s hiperglikemijom nije u potpunosti razumljiv. Međutim, epidemiološke studije sugeriraju povećan rizik od nuspojava povezanih s hiperglikemijom u bolesnika liječenih atipičnim antipsihoticima uključenim u ove studije.
Bolesnike s utvrđenom dijagnozom šećerne bolesti koji su započeli s atipičnim antipsihoticima potrebno je redovito nadzirati radi pogoršanja kontrole glukoze. Pacijenti s faktorima rizika za dijabetes melitus (npr. Pretilost, obiteljska povijest dijabetesa) koji počinju liječenje atipični antipsihotici trebali bi biti podvrgnuti ispitivanju glukoze u krvi na početku liječenja i periodično tijekom tretman. Svakog pacijenta liječenog atipičnim antipsihoticima treba nadzirati zbog simptoma hiperglikemije, uključujući polidipsiju, poliuriju, polifagiju i slabost. Bolesnici koji tijekom liječenja atipičnim antipsihoticima razviju simptome hiperglikemije trebali bi biti podvrgnuti ispitivanju glukoze u krvi nakon posta. U nekim slučajevima hiperglikemija je nestala nakon prekida atipičnog antipsihotika; Međutim, neki su pacijenti zahtijevali nastavak antidijabetičkog liječenja unatoč prekidu sumnjivog lijeka.
Podaci iz ispitivanja s fiksnom dozom u odraslih ispitanika sa shizofrenijom u trajanju od 4 tjedna, u kojem su uzeti uzorci krvi na vrijeme, prikazani su u tablici 1.
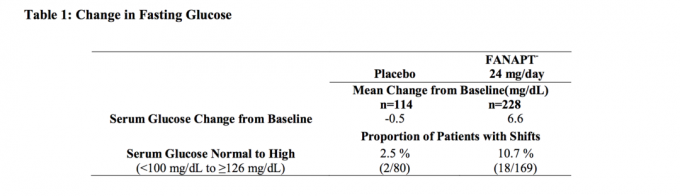
Skupne analize podataka o glukozi iz kliničkih studija, uključujući dugotrajna ispitivanja, prikazane su u tablici 2.

dislipidemija
Uočene su neželjene promjene u lipidima kod bolesnika liječenih atipičnim antipsihoticima.
Podaci iz studije fiksne doze, kontrolirane placebom, u kojoj su uzeti 4 uzorka krvi na vrijeme, kod odraslih osoba sa shizofrenijom prikazani su u Tablici 3.

Skupne analize podataka o kolesterolu i trigliceridima iz kliničkih studija, uključujući dugotrajna ispitivanja, prikazane su u Tablici 4 i Tablici 5.
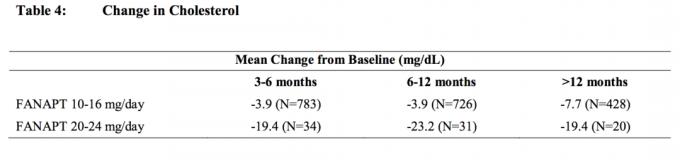
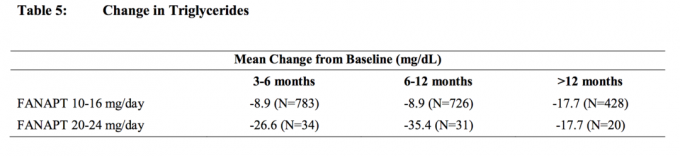
Povećanje težine
Primjećeno je povećanje tjelesne težine kod netipičnih primjena antipsihotika. Preporučuje se klinički nadzor tjelesne težine.
U svim kratkoročnim i dugoročnim studijama ukupna srednja promjena od početne vrijednosti na krajnjoj točki iznosila je 2,1 kg.
Promjene u tjelesnoj težini (kg) i udjela ispitanika s povećanjem tjelesne težine ≥7% od 4 prikazane su placebo kontrolirane studije s fiksnom ili fleksibilnom dozom u odraslih ispitanika s 4- ili 6 tjedana, koje su kontrolirane placebom Tablica 6.
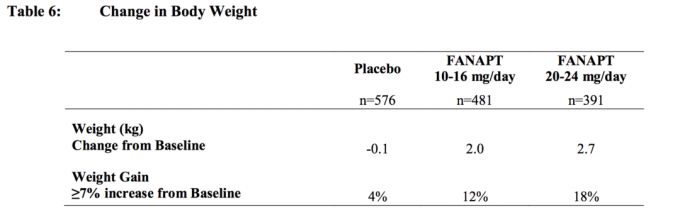
napadaji
U kratkoročnim placebo kontroliranim ispitivanjima (4- do 6 tjedana) napadaji su se pojavili u 0,1% (1/1344) bolesnika liječenih FANAPT-om u usporedbi s 0,3% (2/587) na placebu. Kao i kod drugih antipsihotika, FANAPT treba oprezno primjenjivati u bolesnika s napadima u povijesti ili sa stanjima koja potencijalno snižavaju prag napadaja. Uvjeti koji snižavaju prag napadaja mogu biti prevladavajući u populaciji starijoj od 65 godina.
Ortostatska hipotenzija i sinkopa
FANAPT može izazvati ortostatsku hipotenziju povezanu s vrtoglavicom, tahikardijom i sinkopom. To odražava njegova svojstva alfa1-adrenergičkih antagonista. U dvostruko slijepim placebo kontroliranim kratkoročnim ispitivanjima, gdje se doza polako povećavala, kao što je preporučeno gore, prijavljen je sinkop kod 0,4% (5/1344) bolesnika liječenih FANAPT-om, u usporedbi s 0,2% (1/587) placebo. Orthostatska hipotenzija zabilježena je u 5% bolesnika koji su primali 20-24 mg / dan, 3% bolesnika dobivalo je 10-16 mg / dan, a 1% bolesnika koji su dobivali placebo. Očekuje se da će brže titranje povećati stopu ortostatske hipotenzije i sinkopa.
FANAPT treba primjenjivati s oprezom u bolesnika s poznatom kardiovaskularnom bolešću (npr. Zatajenje srca, povijest infarkta miokarda, ishemija ili provođenje abnormalnosti), cerebrovaskularnu bolest ili stanja koja pacijenta predisponiraju na hipotenziju (dehidracija, hipovolemija i liječenje antihipertenzivom lijekovi). Potrebno je uzeti u obzir praćenje ortostatskih vitalnih znakova u bolesnika koji su osjetljivi na hipotenziju.
Leukopenija, neutropenija i agranulocitoza
U kliničkom ispitivanju i iskustvu nakon stavljanja lijeka u promet, zabilježeni su događaji leukopenije / neutropenije vremenski povezani s antipsihoticima. Zabilježena je i agranulocitoza (uključujući smrtne slučajeve).
Mogući čimbenici rizika za leukopeniju / neutropeniju uključuju prethodno postojeću nisku broju bijelih krvnih stanica (WBC) i povijest lijekova izazvane leukopenijom / neutropenijom. Pacijenti s prethodno postojanim niskim WBC ili anamneziranom leukopenijom / neutropenijom izazvanom lijekovima trebali bi imati potpunu krvnu sliku (CBC) često tijekom prvih nekoliko mjeseci terapije, te treba prekinuti lijek FANAPT kod prvih znakova pada WBC-a u odsutnosti drugih uzročnika čimbenici.
Bolesnike s neutropenijom treba pažljivo nadzirati zbog vrućice ili drugih simptoma ili znakova infekcije i odmah ih liječiti ako se pojave takvi simptomi ili znakovi. Bolesnici s teškom neutropenijom (apsolutni broj neutrofila <1000 / mm3) trebali bi prekinuti lijek FANAPT i pratiti njihov WBC do oporavka.
hiperprolaktinemija
Kao i drugi lijekovi koji antagoniziraju receptore dopamina D2, FANAPT podiže razinu prolaktina.
Hiperprolaktinemija može suzbiti hipotalamički GnRH, što rezultira smanjenom izlučivanjem gonadotropina hipofize. Ovo zauzvrat može inhibirati reproduktivnu funkciju narušavajući gonadalsteroidogenezu i kod žena i kod muškaraca. Prijavljeni su galaktoreja, amenoreja, ginekomastija i impotencija sa spojevima koji podižu prolaktin. Dugotrajna hiperprolaktinemija povezana s hipogonadizmom može dovesti do smanjene gustoće kostiju i kod žena i kod muškaraca.
Eksperimenti s kulturom tkiva pokazuju da otprilike jedna trećina raka dojke kod ljudi ovisi o prolaktinu in vitro, a faktor potencijalne važnosti ako se predviđa propisivanje ovih lijekova kod pacijenta s ranije otkrivenom dojkom Rak. Proliferativne promjene i povećanje serumskog prolaktina u mliječnoj žlijezdi zabilježene su kod miševa i štakora liječenih FANAPT-om. Ni kliničke studije niti epidemiološke studije provedene do danas nisu pokazale povezanost između kronične primjene ove klase lijekova i tumorigeneze kod ljudi; trenutno se smatra da je raspoloživi dokaz previše ograničen da bi bio konačan.
U kratkoročnom ispitivanju placeba kontroliranog (4 tjedna) srednja promjena od početne do krajnje točke u plazmi prolaktina za skupinu liječenu FANAPT 24 mg / dan bio je porast od 2,6 ng / ml u usporedbi sa smanjenjem od 6,3 ng / ml u placebo grupu. U ovom su ispitivanju zabeležene povišene razine prolaktina u plazmi kod 26% odraslih koji su liječeni FANAPT-om u usporedbi s 12% u skupini koja je primala placebo. U kratkotrajnim ispitivanjima, FANAPT je bio povezan sa skromnim razinama povišenja prolaktina u usporedbi s većim povišenjima prolaktina primijećenim s nekim drugim antipsihoticima. U skupnoj analizi iz kliničkih studija koja uključuje i dugotrajna ispitivanja, kod 3210 odraslih osoba liječenih iloperidonom zabilježena je ginekomastija kod dva ispitanika muškog pola (0,1%) u usporedbi s 0% u bolesnika liječenih placebom, a galaktoreja je zabilježena kod 8 ispitanika (0,2%) u usporedbi s 3 žene (0,5%) u liječenja placebom pacijenata.
Regulacija tjelesne temperature
Poremećaj tjelesne sposobnosti da smanjuje tjelesnu tjelesnu temperaturu pripisan je antipsihoticima. Savjetuje se odgovarajuća pažnja prilikom propisivanja FANAPT-a pacijentima koji će imati uvjete koji mogu pridonijeti povišenju jezgre temperaturu, npr. naporno vježbanje, izlaganje ekstremnim vrućinama, primanje istodobnih lijekova s antiholinergičkim djelovanjem ili podvrgavanje dehidracija.
disfagija
Dismotilnost i aspiracija jednjaka povezani su s primjenom antipsihotika. Aspiracijska pneumonija je čest uzrok obolijevanja i smrtnosti u starijih bolesnika. FANAPT i druge antipsihotske lijekove treba oprezno primjenjivati u bolesnika s rizikom od aspiracijske pneumonije.
samoubistvo
Mogućnost pokušaja samoubojstva svojstvena je psihotičnoj bolesti, a strogi nadzor bolesnika s visokim rizikom trebao bi pratiti terapiju lijekovima. Propisi za FANAPT trebaju biti napisani za najmanju količinu tableta u skladu s dobrim upravljanjem bolesnika kako bi se smanjio rizik od predoziranja.
prijapizam
Zabilježena su tri slučaja priapizma u programu FANAPT koji je prije stavljanja na tržište. Zabilježeno je da lijekovi s blokadom alfa-adrenergičkih učinaka izazivaju priapizam. FANAPT dijeli ovu farmakološku aktivnost. Teški priapizam može zahtijevati kiruršku intervenciju.
Potencijal za kognitivno i motoričko oštećenje
FANAPT, kao i drugi antipsihotici, može narušiti prosudbu, mišljenje ili motoričke sposobnosti. U kratkoročnim, placebo kontroliranim ispitivanjima, zabilježena je somnolencija (uključujući sedaciju) u 11,9% (104/874) odrasli pacijenti liječeni FANAPT-om u dozi od 10 mg / danu ili većoj u odnosu na 5,3% (31/587) liječenih placebo. Pacijente treba upozoriti na rad s opasnim strojevima, uključujući automobile, sve dok nisu dovoljno sigurni da terapija lijekom FANAPT ne utječe negativno na njih.
vrh
Nuspojave
Iskustvo kliničkih studija
Budući da se klinička ispitivanja provode u vrlo različitim uvjetima, postotak nuspojava primijećen je u kliničkom ispitivanju lijeka ne mogu se izravno usporediti sa stopama kliničkih ispitivanja drugog lijeka i ne mogu odražavati stope opažene u kliničkim ispitivanjima praksa. Informacije u nastavku izvedene su iz baze kliničkih ispitivanja za FANAPT koja se sastojala od 3229 pacijenata izloženih FANAPT-u u dozi od 10 mg / danu ili većoj za liječenje shizofrenije. Od toga, 999 je primilo FANAPT najmanje 6 mjeseci, a 657 je bilo izloženo FANAPT-u najmanje 12 mjeseci. Svi ovi pacijenti koji su primali FANAPT sudjelovali su u kliničkim ispitivanjima s više doza. Uvjeti i trajanje liječenja FANAPT-om uvelike su varirali i uključuju (u kategorijama koja se preklapaju), otvorenim oznakama i dvostruko slijepe faze studija, bolnica i ambulanta, studije sa fiksnom i fleksibilnom dozom te kratkoročne i dugoročne studije izloženost.
Podaci predstavljeni u ovim odjeljcima izvedeni su iz skupnih podataka s 4 placebo kontrolirana, 4- ili 6-tjedna, Studije s fiksnom ili fleksibilnom dozom u bolesnika koji su primali FANAPT u dnevnim dozama u rasponu od 10 do 24 mg (N = 874).
Nuspojave koje se javljaju kod incidencije od 2% ili više među pacijentima koji su liječili FANAPT i češće su od placeba
Tablica 7 nabraja skupne pojave nuspojava koje su spontano zabilježene u četiri placebo kontrolirana, 4- ili 6-tjedna, studije s fiksnom ili fleksibilnom dozom, navodeći one reakcije koje su se dogodile u 2% ili više bolesnika liječenih FANAPT-om u bilo kojoj dozi skupina i za koje je učestalost u bolesnika liječenih FANAPT-om u bilo kojoj skupini doza bila veća od incidencije u bolesnika liječenih placebo.

Dozirane nuspojave u kliničkim ispitivanjima
Na temelju prikupljenih podataka iz 4 placebo kontrolirane, 4- ili 6-tjedne studije, fiksne ili fleksibilne doze, nuspojave koje su se dogodile s više od 2% incidencija u bolesnika liječenih FANAPT-om i za koja je učestalost u bolesnika liječenih FANAPT-om 20-24 mg / dan bila dvostruka od incidencije u bolesnici liječeni FANAPT-om od 10 do 16 mg / dan bili su: nelagodnost u trbuhu, vrtoglavica, hipotenzija, ukočenost mišićno-koštanog sustava, tahikardija i težina povećana.
Česte i povezane s lijekovima nuspojave u kliničkim ispitivanjima
Na temelju prikupljenih podataka iz 4 placebo kontrolirane, 4- ili 6-tjedne studije s fiksnom ili fleksibilnom dozom, slijedeće nuspojave pojavile su se u ≥5% učestalosti u liječenih bolesnika s FANAPT-om i barem dva puta placebo štakorima za najmanje 1 dozu: vrtoglavica, suha usta, umor, začepljenost nosa, somnolencija, tahikardija, ortostatska hipotenzija i težina povećana. Vrtoglavica, tahikardija i povećana težina bili su barem dvostruko češći na 20-24 mg / dan nego na 10-16 mg / dan.
Ekstrapiramidalni simptomi (EPS) u kliničkim ispitivanjima
Skupni podaci iz 4 placebo kontrolirane, 4- ili 6- tjedna, fiksne ili fleksibilne doze pružali su informacije o EPS-u. Podaci o štetnim događajima prikupljeni iz tih ispitivanja pokazali su sljedeće stope štetnih događaja vezanih uz EPS kao što su prikazane u tablici 8.

Nuspojave povezane s prekidom liječenja u kliničkim ispitivanjima
Na temelju objedinjenih podataka iz 4 placebo kontrolirane, 4- ili 6-tjedne, fiksne ili fleksibilne studije o doziranju, nije bilo razlika u učestalosti prekida liječenja zbog štetnih događaja između lijeka FANAPT (5%) i placeba (5%) pacijenata. Vrste nuspojava koje su dovele do prekida bile su slične za FANAPT i bolesnike liječene placebom.
Demografske razlike u nuspojavama u kliničkim ispitivanjima
Ispitivanje populacijskih podskupina u 4 placebo-kontrolirane, 4- ili 6-tjedne, fiksne ili studije fleksibilne doze nisu otkrile nikakve dokaze o razlikama u sigurnosti na temelju dobi, spol ili rasa.
Abnormalnosti laboratorijskih ispitivanja u kliničkim ispitivanjima
Nije bilo razlike između FANAPT-a i placeba u učestalosti prekida liječenja zbog promjena u hematologiji, analizi mokraće ili kemiji seruma.
U kratkoročnim placebo kontroliranim ispitivanjima (4-6 tjedana) bilo je 1,0% (13/1342) bolesnika liječenih iloperidonom sa hematokrit barem jedanput ispod proširenog normalnog raspona tijekom post-randomizacije, u usporedbi s 0,3% (2/585) na placebo. Prošireni normalni raspon za sniženi hematokrit definiran je u svakom od ovih ispitivanja kao vrijednost 15% ispod normalnog raspona za centralizirani laboratorij koji je korišten u ispitivanju.
Ostale reakcije tijekom pred-marketinške procjene FANAPT-a
Slijedi popis termina MedDRA koji odražavaju nuspojave kod pacijenata liječenih FANAPT-om u višestrukim dozama ≥ 4 mg / dan tijekom bilo koje faze ispitivanja s bazom podataka od 3210 liječenih FANAPT-om pacijenata. Sve prijavljene reakcije uključuju se, osim onih koje su već navedene u tablici 7, ili drugim dijelovima nuspojava (6), onima koji su razmotreni u Upozorenja i mjere predostrožnosti (5), oni pojmovi reakcija koji su bili toliko opći da su neinformativni, reakcije prijavljene u manje od 3 pacijenta i koje nisu bile ozbiljne niti opasne po život, reakcije koje su inače uobičajene kao pozadinske reakcije i reakcije za koje se smatra da nisu lijek povezane.
Reakcije se dalje kategoriziraju prema MedDRA organskom sustavu i navode prema redoslijedu sa smanjenjem učestalosti Definicije: česti neželjeni događaji su oni koji se javljaju kod najmanje 1/100 bolesnika (u njima su samo oni koji nisu navedeni u tablici 7) podacima); rijetke nuspojave su one koje se javljaju u 1/100 do 1/1000 bolesnika; rijetki su događaji koji se javljaju u manje od 1/1000 bolesnika.
Krvni i limfni poremećaji: rijetko - anemija, anemija nedostatka željeza; Rijetke-leukopenija
Srčani poremećaji: učestali - palpitacije; Rijetki - aritmija, atrioventrikularni blok prvog stupnja, zatajenje srca (uključujući kongestivno i akutno)
Poremećaji uha i labirinta: rijetko - vertigo, zujanje u ušima
Endokrini poremećaji: rijetko - hipotireoza
Poremećaji očiju: česti - konjuktivitis (uključujući alergijski); Nerijetko - suhoće oka, blefaritis, edem očnih kapaka, oticanje oka, lentikularna neprozirnost, katarakta, hiperemija (uključujući konjunktivu)
Gastrointestinalni poremećaji: rijetko - gastritis, hipersekrecija pljuvačke, inkontinencija fekalija, ulceracija usta; Rijetki - aftozni stomatitis, dvanaestopalačni čir, hiatusna hernija, hiperhlorhidrija, ulceracija usne, refluksni ezofagitis, stomatitis
Opći poremećaji i administrativni uvjeti na licu mjesta: rijetki - edemi (opći, sitničavost zbog srčane bolesti), poteškoće u hodanju, žeđ; Rijetka - hipertermija
Hepatobilijarni poremećaji: rijetko - kolelitijaza
Ispitivanja: česta: težina smanjena; Nerijetko - smanjen je hemoglobin, povećao se broj neutrofila, smanjio se hematokrit
Poremećaji metabolizma i prehrane: Rijetko - povećani apetit, dehidracija, hipokalemija, zadržavanje tekućine
Poremećaji mišićno-koštanog sustava i vezivnog tkiva: česti - mialgija, grčevi mišića; Rijetka - tortikolis
Poremećaji živčanog sustava: česta - parestezija, psihomotorna hiperaktivnost, nemir, amnezija, nistagmus; Rijedak - sindrom nemirnih nogu
Psihijatrijski poremećaji: česti - nemir, agresija, zabluda; Nerijetko - neprijateljstvo, smanjenje libida, paranoja, anorgazmija, konfuzno stanje, manija, katatonija, promjene raspoloženja, panika napad, opsesivno-kompulzivni poremećaj, bulimija nervoza, delirij, psihogeni polidipsija, poremećaj kontrole impulsa, glavni depresija
Bubrežni i mokraćni poremećaji: česte - urinarna inkontinencija; Nerijetko - disurija, pollakiurija, enureza, nefrolitijaza; Rijetki - zadržavanje mokraće, akutno bubrežno zatajenje
Poremećaji reproduktivnog sustava i dojke: česta - erektilna disfunkcija; Infrequen - bol u testisima, amenoreja, bol u dojkama; Rijetke - menstruacija neredovita, ginekomastija, menoragija, metroragija, krvarenje u postmenopauzi, prostatitis.
Respiracijski, torakalni i medijastinalni poremećaji: rijetko - epistaksa, astma, rinoreja, zagušenje sinusa, suhoća nosa; Rijetki - suho grlo, sindrom apneje u snu, dispneja
Iskustvo nakon marketinga
Sljedeće nuspojave utvrđene su tijekom primjene lijeka FANAPT nakon odobrenja: retrogradna reakcija ejakulacije i preosjetljivosti (uključujući anafilaksiju; angioedem; stezanje grla; oteklina orofaringeusa; oticanje lica, usana, usta i jezika; urtikarija; osip; i pruritus). Kako su ove reakcije dobrovoljno prijavljene iz populacije nesigurne veličine, nije moguće pouzdano procijeniti njihovu učestalost niti uspostaviti uzročno-posljedičnu vezu s izlaganjem lijekovima.
vrh
Interakcije s lijekovima
S obzirom na primarne učinke FANAPT-a na CNS, treba biti oprezan kada se uzima u kombinaciji s drugim drogama i alkoholom središnjeg djelovanja. Zbog antagonizma alfa1-adrenergičkih receptora, FANAPT može pojačati učinak određenih antihipertenzivnih lijekova.
Mogućnost da drugi lijekovi utječu na FANAPT
Iloperidon nije supstrat enzima CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ili CYP2E1. To upućuje na zaključak da je interakcija iloperidona s inhibitorima ili induktorima ovih enzima ili drugim čimbenicima, poput pušenja, malo vjerojatna. I CYP3A4 i CYP2D6 odgovorni su za metabolizam iloperidona. Inhibitori CYP3A4 (npr. Ketokonazol) ili CYP2D6 (npr. Fluoksetin, paroksetin) mogu inhibirati eliminaciju iloperidona i uzrokovati povećanu razinu u krvi.
Ketokonazol: Istodobna primjena ketokonazola (200 mg dva puta dnevno tijekom 4 dana), moćnog inhibitora CYP3A4, s 3 mg jednostruke doze iloperidona na 19 zdravi volonteri, u dobi od 18 do 45 godina, povećali su površinu ispod krivulje (AUC) iloperidona i njegovih metabolita P88 i P95 za 57%, 55% i 35%, odnosno. Doze iloperidona treba smanjiti za otprilike jednu polovinu kada se primjenjuju s ketokonazolom ili drugim jakim inhibitorima CYP3A4 (npr. Itrakonazolom). Slabiji inhibitori (npr. Eritromicin, sok od grejpa) nisu proučavani. Kada se inhibitor CYP3A4 povuče iz kombinirane terapije, dozu iloperidona treba vratiti na prethodnu razinu.
Fluoksetin: Istodobna primjena fluoksetina (20 mg dva puta dnevno tijekom 21 dana), snažni inhibitor CYP2D6, s jednom dozom 3 mg iloperidona 23 zdravim dobrovoljcima u dobi od 29-44 godine, koji su klasificirani kao CYP2D6 ekstenzivni metabolizatori, povećali su AUC iloperidona i njegovog metabolita P88, za oko 2- do 3 puta, a AUC njegovog metabolita P95 smanjili za jedna polovina. Doze iloperidona treba smanjiti za polovicu kada se primjenjuju s fluoksetinom. Kada se fluoksetin povuče iz kombinirane terapije, dozu iloperidona treba vratiti na prethodnu razinu. Očekuje se da će drugi jaki inhibitori CYP2D6 imati slične učinke i da će im trebati odgovarajuće smanjenje doze. Kad se inhibitor CYP2D6 povuče iz kombinirane terapije, doza iloperidona može se tada povećati na prethodnu razinu.
Paroksetin: Istodobna primjena paroksetina (20 mg / dan tijekom 5-8 dana), snažni inhibitor CYP2D6, s višestrukim dozama iloperidona (8 ili 12 mg dva puta dnevno) bolesnicima sa šizofrenijom u dobi od 18 do 65 godina što je rezultiralo povećanom srednjom vršnom koncentracijom ustaljenog sustava od iloperidon i njegov metabolit P88, otprilike 1,6 puta, i smanjili su prosječne vršne koncentracije metabolita P95 u stalnom stanju jedna polovina. Doze iloperidona trebaju se smanjiti za polovicu kada se primjenjuju paroksetin. Kada se paroksetin povuče iz kombinirane terapije, dozu iloperidona treba vratiti na prethodnu razinu. Očekuje se da će drugi jaki inhibitori CYP2D6 imati slične učinke i da će im trebati odgovarajuće smanjenje doze. Kad se inhibitor CYP2D6 povuče iz kombinirane terapije, doza iloperidona može se tada povećati na prethodne razine.
Paroksetin i ketokonazol: Istodobna primjena paroksetina (20 mg jednom dnevno tijekom 10 dana), inhibitora CYP2D6 i ketokonazola (200 mg dva puta dnevno) s višestrukim dozama iloperidona (8 ili 12 mg dva puta dnevno) bolesnicima sa šizofrenijom u dobi od 18-65 godina rezultiralo je s 1.4 kratki porast koncentracija iloperidona i njegovog metabolita u ustaljenom stanju i 1,4-postotno smanjenje P95 u prisutnosti paroksetin. Dakle, davanje iloperidona sa inhibitorima oba njegova metabolička puta nije dovelo do učinka nijednog inhibitora koji se daje sam. Doze iloperidona treba stoga smanjiti za otprilike jednu polovinu ako se primjenjuju istodobno s inhibitorom CYP2D6 i CYP3A4.
Potencijal FANAPT-a da utječe na druge lijekove
Studije in vitro na mikrosomima jetre čovjeka pokazale su da iloperidon ne inhibira značajno metabolizam lijekovi metabolizirani sljedećim izoenimima citokroma P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 ili CYP2E1. Nadalje, in vitro studije na mikrosomima jetre čovjeka pokazale su da iloperidon ne izaziva enzim svojstva, posebno za sljedeće izocime citokroma P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 i CYP3A5.
Dekstrometorfan: Ispitivanje zdravih dobrovoljaca pokazalo je da se promjene u farmakokinetikama dekstrometorfana (doza od 80 mg) kada doza od 3 mg istodobna primjena iloperidona rezultirala je povećanjem ukupne izloženosti od 17% i najvišom koncentracijom C max u plazmi za 26% dekstrometorfan. Dakle, interakcija između iloperidona i ostalih supstrata CYP2D6 nije vjerojatna.
Fluoksetin: Pojedinačna doza iloperidona od 3 mg nije utjecala na farmakokinetiku fluoksetina (20 mg dva puta dnevno).
Midazolam (osjetljivi supstrat za CYP 3A4): Studija u bolesnika sa shizofrenijom pokazala je manje od 50% porasta ukupnog midazolama izloženost ustaljenom stanju iloperidona (14 dana oralnog doziranja do 10 mg iloperidona dva puta dnevno) i nema učinka na midazolam C maks. Dakle, interakcija između iloperidona i ostalih supstrata CYP3A4 nije vjerojatna.
Lijekovi koji produžuju interval QT FANAPT ne smiju se koristiti s bilo kojim drugim lijekovima koji produljuju QT interval.
vrh
Upotrijebite za određene populacije
Registar izloženosti trudnoći
Postoji registar izloženosti trudnoći koji prati ishode trudnoće kod žena koje su bile izložene FANAPT-u tijekom trudnoće. Za više informacija kontaktirajte Nacionalni registar trudnoće za atipične antipsihotike na 1-866-961-2388 ili posjetite http://womensmentalhealth.org/clinical-and -research-programa / pregnancyregistry /.
Sažetak rizika
Novorođenčad čije su majke izložene antipsihotičkim lijekovima, uključujući FANAPT, tijekom trećeg tromjesečja trudnoće izložene su riziku za ekstrapiramidne i / ili simptome povlačenja nakon poroda. Ograničeni dostupni podaci s FANAPT-om u trudnica nisu dovoljni za informiranje o riziku povezanom s lijekovima većih urođenih oštećenja i pobačaja. Iloperidon nije bio teratogen kada se oralno primjenjivao trudnim štakorima tijekom organogeneze u dozama do 26 puta većim od preporučene ljudske doze od 24 mg / dan, na osnovi mg / m2. Međutim, produžilo je trajanje trudnoće i porođaja, povećalo mrtvorođenje, rane intrauterine smrti, povećalo učestalost kašnjenja u razvoju i smanjilo preživljavanje štenad nakon porođaja. Iloperidon nije bio teratogen kada se oralno davao trudnim zečevima tijekom organogeneze u dozama do 20 puta s MRHD-om na osnovi mg / m2. Međutim, povećala je ranu intrauterinu smrt i smanjila vitalnost fetusa pri najvišoj dozi, koja je također bila toksična za majku.
Pozadinski rizik većih urođenih mana i pobačaja za navedenu populaciju nije poznat. U američkoj općoj populaciji, procijenjeni pozadinski rizik od velikih urođenih mana i pobačaja u klinički priznatim trudnoćama je 2-4%, odnosno 15-20%, respektivno.
Klinička razmatranja
Fetalni / neonatalni nuspojave
Ekstrapiramidalni i / ili simptomi odvikavanja, uključujući agitaciju, hipertoniju, hipotoniju, tremor, somnolenciju, respiratorne tegobe i prijavljeni su poremećaji hranjenja kod novorođenčadi čije su majke bile izložene antipsihotičkim lijekovima tijekom trećeg tromjesečja trudnoća. Ovi simptomi su varirali u težini. Neki novorođenčadi oporavili su se unutar sati ili dana bez posebnog liječenja; drugima je bila potrebna produžena hospitalizacija. Pratite novorođenčad za simptome ekstrapiramida i / ili povlačenja i na odgovarajući način upravljajte simptomima.
Podaci
Podaci o životinjama
U istraživanju embrionalno-fetalnog razvoja trudnicama se davalo 4, 16 ili 64 mg / kg dnevno (1,6, 6,5 i 26 puta više od maksimalna preporučena humana doza (MRHD) od 24 mg / dan na osnovi mg / m2) iloperidona oralno tijekom razdoblja organogeneza. Najveća doza uzrokovala je povećane rane intrauterine smrti, smanjenu težinu i dužinu fetusa, smanjena kostna kost skeleta fetusa i povećana učestalost manjih anomalija skeleta fetusa i varijacije; ta je doza također uzrokovala smanjenu konzumaciju hrane za majke i debljanje.
U istraživanju embrionalno-fetalnog razvoja trudnoćim zečevima davano je 4, 10 ili 25 mg / kg / dan (3, 8 i 20 puta MRHD na osnovi mg / m2) iloperidona tijekom razdoblja organogeneze. Najveća doza uzrokovala je povećane rane intrauterine smrti i smanjenu vitalnost fetusa pri terminu; ova je doza također uzrokovala toksičnost za majku.
U dodatnim ispitivanjima u kojima su štakorima davani iloperidon u dozama sličnim gornjim počevši ili od prije začeća ili od 17. dana gestacije, a nastavljajući se putem odvikavanja, štetni reproduktivni učinci uključivali su produljenu trudnoću i porođaj stopa mrtvorođene djece, povećana incidencija fecetalnih visceralnih varijacija, smanjena težina fetusa i štenećaka te smanjena post-porođajna štenad opstanak. Nije bilo učinaka lijekova na neurobehevioralni ili reproduktivni razvoj preživjelih štenaca. Doze bez učinka bile su u rasponu od 4 do 12 mg / kg, osim povećanja stope mrtvorodjenosti koja se dogodila kod najniže testirane doze od 4 mg / kg, što je 1,6 puta više od MRHD-a na osnovi mg / m2. U tim studijama toksičnost za majku zabilježena je u većim dozama.
Metabolit iloperidon P95, koji je glavni cirkulirajući metabolit iloperidona kod ljudi, ali nije prisutan u značajne količine u štakora davane su trudnim štakorima tijekom perioda organogeneze oralnim dozama od 20, 80 ili 200 mg kg / dan. Nisu zabilježeni teratogeni učinci. Zakašnjela kostna kost nastala je u svim dozama. Nije proizvedena značajna toksičnost za majku. Razina plazme P95 (AUC) pri najvišoj testiranoj dozi bila je 2 puta viša od one u ljudi koji su primili MRHD iloperidona.
laktacija
Sažetak rizika
Nema podataka o prisutnosti iloperidona ili njegovih metabolita u majčinom mlijeku, učinci iloperidona na dojeno dijete, niti učinci iloperidona na majčino mlijeko proizvodnja. Iloperidon je prisutan u mlijeku za štakore. Zbog mogućnosti ozbiljnih nuspojava u dojenačke djece, savjetujte ženi da ne doji tijekom liječenja lijekom FANAPT.
Podaci Prijenos radioaktivnosti u mlijeko štakora je dojenčad ispitan nakon jedne doze [14C] iloperidona od 5 mg / kg. Koncentracija radioaktivnosti u mlijeku u 4 sata nakon doze bila je približno 10 puta veća od koncentracije u plazmi u isto vrijeme. Međutim, već 24 sata nakon doziranja koncentracije radioaktivnosti u mlijeku pale su na vrijednosti nešto niže od plazme. Metabolički profil u mlijeku bio je kvalitativno sličan onome u plazmi.
Pedijatrijska upotreba Sigurnost i učinkovitost kod djece i adolescenata nisu utvrđene.
Gerijatrijska upotreba
Kliničke studije FANAPT-a u liječenju shizofrenije nisu uključivale dovoljan broj bolesnici stariji od 65 godina kako bi se utvrdilo reagiraju li ili ne drugačije od mlađe odrasle osobe pacijenata. Od 3210 pacijenata liječenih FANAPT-om u ispitivanjima prije stavljanja na tržište, 25 (0,5%) je bilo starije od 65 godina, a nije bilo pacijenata starijih od 75 godina.
Stariji bolesnici s psihozom povezanom sa demencijom liječeni FANAPT-om povećani su rizik od smrti u usporedbi s placebom. FANAPT nije odobren za liječenje bolesnika s demencijom povezanom sa demencijom.
Oštećenje bubrega
Budući da je FANAPT visoko metaboliziran, s manje od 1% lijeka izlučeno je nepromijenjeno, samo bubrežno oštećenje vjerojatno neće imati značajan utjecaj na farmakokinetiku FANAPT-a. Bubrežno oštećenje (klirens kreatinina <30 ml / min) imalo je minimalan učinak na Cmax iloperidona (dan u jednoj dozi od 3 mg) i njegovih metabolita P88 i P95 u bilo kojem od izmjerenih 3analata. AUC0 - ∞ je porastao za 24%, smanjen je za 6%, a porastao je za 52% za iloperidon, P88 i P95, kod osoba sa oštećenjem bubrega.
Oštećenje jetre
Nije potrebno prilagođavanje doze FANAPT-u u bolesnika s blagim oštećenjem jetre. Pacijenti s umjerenim oštećenjem jetre mogu zahtijevati smanjenje doze. FANAPT se ne preporučuje pacijentima s ozbiljnim oštećenjem jetre.
U odraslih ispitanika s blagim oštećenjem jetre nije primijećena značajna razlika u farmakokinetikama iloperidona, P88 ili P95 (ukupno ili nevezano) u usporedbi sa kontrolnim skupinama zdravih odraslih. U ispitanika s umjerenim oštećenjem jetre veća (dvostruka) i varijabilnija slobodna izloženost aktivnim metabolitima P88 bila je U usporedbi sa zdravim kontrolama, općenito je izloženost iloperidonu i P95 slična (manje od 50% u odnosu na kontrolirati). Budući da ispitivanje kod teških osoba s oštećenjem jetre nije provedeno, FANAPT se ne preporučuje bolesnicima s ozbiljnim oštećenjem jetre.
Status pušenja
Na temelju ispitivanja in vitro upotrebe ljudskih jetrenih enzima, FANAPT nije supstrat za CYP1A2; pušenje stoga ne bi trebalo utjecati na farmakokinetiku FANAPT-a.
Trudnoća
vrh
Zlouporaba droge i ovisnost
Kontrolirana supstanca
FANAPT nije kontrolirana tvar.
Zlostavljanje
FANAPT nije sustavno proučavan na životinjama i ljudima zbog mogućnosti zlostavljanja, tolerancije ili fizičke ovisnosti. Iako klinička ispitivanja nisu otkrila tendenciju ponašanja kod traženja lijekova, ova opažanja nisu bila sustavna i nisu moguća predvidjeti na temelju ovog iskustva u kojoj će mjeri lijek CNS-a, FANAPT, biti zloupotrijebljen, preusmjeren i / ili zlorabljen jednom prodali. Slijedom toga, bolesnike treba pažljivo ocijeniti zbog povijesti zlouporabe droga, a takvi trebaju biti pažljivo promatrano zbog znakova zlouporabe ili zlouporabe FANAPT-a (npr. razvoj tolerancije, povećanje doze, traženje lijeka) ponašanje).
vrh
predoziranje
Ljudsko iskustvo
U pokusnim ispitivanjima koja su uključivala više od 3210 pacijenata, došlo je do slučajnog ili namjernog predoziranja FANAPT-a dokumentirano u 8 bolesnika u rasponu od 48 mg do 576 mg uzetih odjednom i 292 mg tijekom 3 dana razdoblje. Iz ovih slučajeva nije zabilježeno nikakvih smrtnih slučajeva. Najveća potvrđena pojedinačna konzumacija FANAPT-a bila je 576 mg; nisu primijećeni štetni fizički učinci kod ovog pacijenta. Sljedeći najveći potvrđeni unos FANAPT-a bio je 438 mg tijekom razdoblja od 4 dana; prijavljeni su ekstrapiramidni simptomi i QTc interval od 507 msec za ovog pacijenta bez srčanih posljedica. Ovaj je pacijent nastavio liječenje FANAPT-om dodatnih 11 mjeseci.
Općenito, prijavljeni znakovi i simptomi bili su oni koji su rezultat pretjerivanja poznatih farmakoloških učinaka (npr. Pospanosti i sedacije, tahikardije i hipotenzije) FANAPT-a.
Upravljanje predoziranjem
Ne postoji specifičan protuotrov za FANAPT. Stoga je potrebno uvesti odgovarajuće potporne mjere. U slučaju akutnog predoziranja, liječnik treba uspostaviti i održavati dišni put i osigurati odgovarajuću oksigenaciju i ventilaciju. Treba uzeti u obzir ispiranje želuca (nakon intubacije, ako je pacijent u nesvijesti) i primjenu aktivnog ugljena zajedno s laksativom. Mogućnost začepljenja, napadaja ili distonična reakcija glave i vrata nakon predoziranja može stvoriti rizik od aspiracije izazvanom povraćanjem. Kardiovaskularni nadzor trebao bi započeti odmah i trebao bi uključivati kontinuirano praćenje EKG-om radi otkrivanja mogućih aritmija. Ako se primjenjuje antiaritmička terapija, ne smije se koristiti disopiramid, prokainamid i kinidin, jer oni mogu imati QT-produžujući učinak koji može biti aditivan onome FANAPT-a. Slično tome, razumno je očekivati da svojstva bretilija koje blokiraju alfa mogu biti aditivna onima FANAPT-a, što rezultira problematičnom hipotenzijom. Hipotenziju i krvotok treba liječiti odgovarajućim mjerama kao što su intravenska tekućina ili simpatikomimetičari (epinefrin i dopamin se ne smiju koristiti, jer beta stimulacija može pogoršati hipotenziju u postavljanju alfa induciranog FANAPT-om blokada). U slučajevima teških ekstrapiramidnih simptoma treba primijeniti antikolinergičke lijekove. Pomni liječnički nadzor treba nastaviti dok se pacijent ne oporavi.
vrh
Opis
FANAPT je atipični antipsihotik koji pripada kemijskoj klasi derivata piperidinil-benzisoksazola. Njegov kemijski naziv je 4 '- [3- [4- (6-fluoro-1,2-benzisoksazol-3-il) piperidino] propoksi] -3'-metoksiacetofenon. Njegova molekularna formula je C24H27FN2O4, a njegova molekularna težina je 426,48. Strukturna formula je:
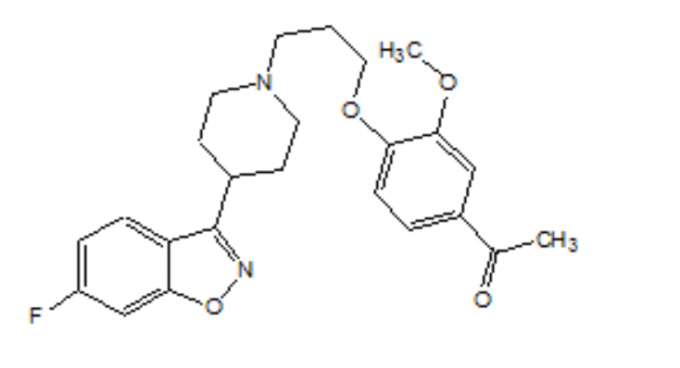
Iloperidon je fini kristalni prah od bijelog do gotovo bijelog. Praktično je netopljiv u vodi, vrlo slabo topljiv u 0,1 N HCl i slobodno topiv u kloroformu, etanolu, metanolu i acetonitrilu.
FANAPT tablete namijenjene su samo oralnoj primjeni. Svaki krug, bez premaza
tableta sadrži 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ili 12 mg iloperidona. Neaktivni sastojci su: laktoza monohidrat, mikrokristalna celuloza, hidroksipropilmetilceluloza, krospovidon, magnezijev stearat, koloidni silicij
dioksid i pročišćena voda (uklanja se tijekom obrade). Tablete su bijele, okrugle, ravne, iskrivljene i označene su s logotipom "" s utisnutim s jedne strane i s jačinom tableta "1", "2", "4", "6", "8", "10", ili "12" utisnuto s druge strane.
vrh
Klinička farmakologija
Mehanizam djelovanja
Mehanizam djelovanja iloperidona kod shizofrenije nije poznat. Međutim, učinkovitost iloperidona može se posredovati kombinacijom antagonizma dopamina tipa 2 (D2) i serotonina tipa 2 (5-HT2).
Iloperidon tvori aktivni metabolit, P88, koji ima profil vezivanja in vitro receptora sličan matičnom lijeku.
farmakodinamiku
Iloperidon djeluje kao antagonist visokog (nM) afiniteta koji se veže na serotonin 5-HT2A dopamin D2 i D3receptori i norepinefrinski NEα1 receptori (vrijednosti Ki od 5,6, 6,3, 7,1 i 0,36 nM, odnosno). Iloperidon ima umjereni afinitet za dopamin D4 i serotoninske receptore 5-HT6 i 5 -HT7 (Ki vrijednosti 25, 43 i 22, nM respektivno) i nizak afinitet za serotonin 5-HT1A, dopamin D1 i histamin H1 receptore (Ki vrijednosti 168, 216 i 437 nM, odnosno). Iloperidon nema značajan afinitet (Ki> 1000 nM) za kolinergične muskarinske receptore. Afinitet metabolita iloperidona P88 općenito je jednak ili manji od matičnog spoja, dok je samo metabolit P95 pokazuje afinitet za 5-HT2A (Ki vrijednost 3,91) i receptore NEα1A, NEα1B, NEα1D i NEα2C (Ki vrijednosti 4,7, 2,7, 8,8 i 4,7 nM odnosno).
farmakokinetika
Promijećeni srednji poluživot eliminacije za iloperidon, P88 i P95 u širokim metabolizatorima CYP2D6 (EM) su 18, 26 i 23 sata, a u lošim metabolizatorima (PM) su 33, 37 i 31 sat. Koncentracije u stanju dinamičke ravnoteže postižu se u roku od 3 do 4 dana nakon doziranja. Akumulacija iloperidona predviđa se iz farmakokinetike pojedinačne doze. Farmakokinetika iloperidona je više nego proporcionalna dozi. Eliminacija iloperidona odvija se uglavnom kroz jetreni metabolizam koji uključuje 2 P450 izozima, CYP2D6 i CYP3A4.
Apsorpcija: Iloperidon se dobro apsorbira nakon davanja tableta, a najveće koncentracije u plazmi pojavljuju se u roku od 2 do 4 sata; dok je relativna bioraspoloživost formulacije tableta u usporedbi s oralnom otopinom 96%. Primjena iloperidona uz standardni obrok s visokim udjelom masti nije značajno utjecala na Cmax ili AUC iloperidona, P88 ili P95, ali odgodio Tmax za 1 sat za iloperidon, 2 sata za P88 i 6 sati za Str95. FANAPT se može davati bez obzira na obroke.
Raspodjela: Iloperidon ima prividni klirens (klirens / bioraspoloživost) od 47 do 102 L / h, s prividnim volumenom raspodjele od 1340-2800 L. U terapijskim koncentracijama, nevezani udio iloperidona u plazmi je oko 3%, a svakog metabolita (P88 i P95) oko 8%.
Metabolizam i eliminacija: Iloperidon se metabolizira prvenstveno 3 puta biotransformacije: redukcija karbonila, hidroksilacija (posredovana CYP2D6) i O-demetilacija (posredovana CYP3A4). Postoje 2 prevladavajuća metabolizma iloperidona, P95 i P88. Metabolit iloperidona P95 predstavlja 47,9% AUC iloperidona i njegovih metabolita u plazmi u stabilnom stanju za ekstenzivne metabolizatore (EM) i 25% za loše metabolizatore (PM). Aktivni metabolit P88 čini 19,5% i 34,0% ukupne izloženosti plazmi u EM i PM, respektivno.
Otprilike 7% -10% bijelaca i 3% -8% crnaca / Afroamerikanaca nema sposobnost metabolizacije CYP2D6 supstrati i klasificirani su kao loši metabolizatori (PM), dok su ostali intermedijarni, ekstenzivni ili ultrabrzi metabolizmom. Istodobna primjena FANAPT-a s poznatim jakim inhibitorima CYP2D6 poput fluoksetina rezultira u 2,3 puta povećanje izloženosti iloperidonu u plazmi, i stoga bi trebala biti polovica doze FANAPT-a primjenjuje.
Slično tome, PM-ovi CYP2D6 imaju veću izloženost iloperidonu u usporedbi s EM-om, a PM-i bi trebali dozu smanjiti za polovicu. Za identificiranje PM-a CYP2D6 dostupni su laboratorijski testovi.
Najveći dio radioaktivnih materijala oporavljen je u urinu (prosječno 58,2% i 45,1% u EM i PM, respektivno), s izmetom od 19,9% (EM) do 22,1% (PM) dozirane radioaktivnosti.
Interakcija transportera: Iloperidon i P88 nisu supstrati P-gp, a iloperidon je slab inhibitor P-gp.
vrh
Neklinička toksikologija
Kancerogeneza, mutageneza, oštećenje plodnosti
Kancerogeneza: Studije karcinogenosti tokom života provedene su na miševima CD-1 i Sprague Dawley štakorima. Iloperidon je davan oralno, u dozama 2,5, 5,0 i 10 mg / kg / dan miševima CD-1 i 4, 8 i 16 mg / kg / dan za Sprague štakori Dawley (0,5, 1,0 i 2,0 puta i 1,6, 3,2 i 6,5 puta, MRHD od 24 mg / dan na mg / m2 osnova). Pojačana je učestalost zloćudnih tumora mliječne žlijezde kod ženki miševa liječenih samo najnižom dozom (2,5 mg / kg / dan). Nije bilo povećanih neoplazija povezanih s liječenjem kod štakora.
Kancerogeni potencijal metabolita iloperidona P95, koji je glavni cirkulirajući metabolit iloperidona kod ljudi, ali nije prisutan u značajnim količinama u miševa ili štakorima, procijenjeno je u cjeloživotnom istraživanju kancerogenosti za štakore Wistar u oralnim dozama od 25, 75 i 200 mg / kg / dan u muškaraca i 50, 150 i 250 (smanjeno s 400) mg / kg / dan u ženke. Neoplastične promjene povezane s drogom dogodile su se u muškaraca, u hipofizi (pars distalis adenoma) u svim dozama i u gušterači (adenoma staničnog otoka) u velikoj dozi. Razina plazme P95 (AUC) u muškaraca u ispitanim dozama (25, 75 i 200 mg / kg / dan) bila je otprilike 0,4, 3 i 23 puta, čovjekovo izlaganje P95 na MRHD iloperidona.
Mutageneza: Iloperidon je bio negativan u Amesovom testu i na in vivo testovima koštane srži na mišu i jetru štakora. Kromosomske aberacije izazvane iloperidonom in vitro u jajnicima kineskog hrčaka (CHO) u koncentracijama koje su također uzrokovale određenu citotoksičnost.
Metabolit iloperidon P95 bio je negativan u Amesovom testu, testu aberacije kromosomske aberacije V79 i in vivo mikronukleusnom testu mišje koštane srži.
Oštećenje plodnosti: Iloperidon je smanjio plodnost za 12 i 36 mg / kg u studiji u kojoj su tretirane i mužjaci i žene štakori. Doza bez učinka bila je 4 mg / kg, što je 1,6 puta više od MRHD-a od 24 mg / dan, na osnovi mg / m2.
vrh
Kliničke studije
Učinkovitost FANAPT-a u liječenju shizofrenije podržala su 2 placebo i aktivno kontrolirano kratkotrajno (4- i 6-tjedno) ispitivanje i jedno dugoročno placebo kontrolirano randomizirano suđenje za povlačenje. U sva ispitivanja uključeni su pacijenti koji su udovoljavali kriterijima DSM-III / IV za shizofreniju.
U ovom su istraživanju korištena tri instrumenta za procjenu psihijatrijskih znakova i simptoma. Pozitivna i negativna skala sindroma (PANSS) i kratka skala psihijatrijske ocjene (BPRS) obje su zalihe s više stavki.
opće psihopatologije koja se obično koristi za procjenu učinaka liječenja lijekovima kod šizofrenije. Klinička procjena globalnog pojavljivanja (CGI) odražava dojam vještog promatrača, koji je u potpunosti upoznat s manifestacijama shizofrenije, o cjelokupnom kliničkom stanju pacijenta.
Ispitivanje sa 6 tjedana, placebom kontrolirano (n = 706) uključivalo je 2 fleksibilna raspona doza FANAPT-a (12-16 mg / dan ili 20-24 mg / dan) u usporedbi s placebom i aktivnom kontrolom (risperidon). Za skupinu od 12-16 mg / dan, raspored titracije FANAPT-a bio je 1 mg dva puta dnevno 1. i 2. dana, 2 mg dva puta dnevno 3. i 4. dana, 4 mg dva puta dnevno 5. i 6. dana, i 6 mg dva puta dnevno dnevno 7. dana Za skupinu od 20-24 mg / dan, raspored titranja FANAPT-a bio je 1 mg dva puta dnevno 1. dana, 2 mg dva puta dnevno 2. dana, 4 mg dva puta dnevno 3. dana, 6 mg dva puta dnevno 4. i 5. dana, 8 mg dva puta dnevno, 6. dana, i 10 mg dva puta dnevno, 7. dana. Primarna krajnja točka bila je promjena od početne vrijednosti na ukupnom rezultatu BPRS na kraju liječenja (42. dan). I rasponi doza od 12-16 mg / dan i 20-24 mg / dan FANAPT-a bili su bolji od placeba u ukupnom rezultatu BPRS. Činilo se da je aktivni kontrolni antipsihotik u prvom ispitivanju superiorniji od FANAPT-a u ovom ispitivanju tjedana, a nalaz koji se dijelom može objasniti bržim titracijama koje su za to bile moguće droga. U bolesnika u ovoj studiji koji su ostali na liječenju najmanje 2 tjedna, činilo se da iloperidon ima djelotvornu učinkovitost kao i aktivna kontrola.
4-tjedno, placebo kontrolirano ispitivanje (n = 604) uključivalo je jednu fiksnu dozu FANAPT-a (24 mg / dan) u usporedbi s placebom i aktivnu kontrolu (ziprasidon). Raspored titracije za ovu studiju bio je sličan rasporedu za 6-tjedno ispitivanje. Ovo je istraživanje uključivalo titraciju FANAPT-a počevši od 1 mg dva puta dnevno 1. dana i povećavajući se na 2, 4, 6, 8, 10 i 12 mg dva puta dnevno 2., 3., 4., 5., 6. i 7. dana. Primarna krajnja točka bila je promjena od početne vrijednosti na ukupnom rezultatu PANSS na kraju liječenja (28. dan). Doza od 24 mg / dan FANAPT bila je bolja od placeba u ukupnom rezultatu PANSS-a. Čini se da FANAPT ima sličnu djelotvornost kao aktivni kontrolni lijek kojem je također potrebno sporo titriranje do ciljane doze.
U dugoročnijem ispitivanju klinički stabilne odrasle ambulante (n = 303) koje ispunjavaju DSM-IV kriterije za shizofreniju koja je ostala stabilna nakon 12 tjedana otvoreno liječenje fleksibilnim dozama FANAPT-a (8 mg / dan - 24 mg / dan primijenjeno kao doza dva puta dnevno) randomizirano je na placebo ili da nastavi s njihova trenutna doza FANAPT-a (8 mg / dan-24 mg / dan primijenjena kao doza dva puta dnevno) za promatranje mogućeg relapsa tijekom dvostruko slijepog relapsa faza prevencije. Stabilizacija tijekom faze otvorenog obilježavanja definirana je kao da je utvrđena doza FANAPT-a koja je bila nepromijenjena zbog učinkovitosti u 4 tjedna prije randomizacije, s ocjenom CGI-ozbiljnosti od ≤4 i ukupnom ocjenom PANSS ≤70, ocjenom ≤4 na svakoj od sljedećih pojedinačnih stavki PANSS (P1-zabluda, P2-konceptualna neorganizacija, P3-halucinacijsko ponašanje, P6 sumnjivost / progon, P7-neprijateljstvo ili G8-nekooperativnost), i nema hospitalizacije ili povećanja razine skrbi koja bi se liječila egzacerbacije. Relaps ili predstojeći relaps tijekom faze prevencije dvostruko slijepih relapsa definiran je kao bilo koji od slijedeće: hospitalizacija zbog pogoršanja shizofrenije, povećanje (pogoršanje) ukupnog rezultata PANSS-a ≥30%, CGI-
Ocjena poboljšanja ≥6, pacijent je imao suicidno, ubojstvo ili agresivno ponašanje, ili je potrebno bilo koji drugi antipsihotik.

Na temelju privremene analize, neovisno povjerenstvo za praćenje podataka odlučilo je da se studija rano prekine zbog dokaza o učinkovitosti. Na temelju rezultata iz privremene analize, koji su potvrđeni skupom konačnih analiza, bolesnici liječeni FANAPT je doživio statistički značajno duže vrijeme relapsa ili nadolazećeg relapsa u odnosu na bolesnike koji su primili placebo. Slika 1 prikazuje procijenjeni kumulativni udio pacijenata s relapsom ili predstojećim relapsom na temelju konačnog skupa podataka.
vrh
Način isporuke / skladištenja i rukovanje
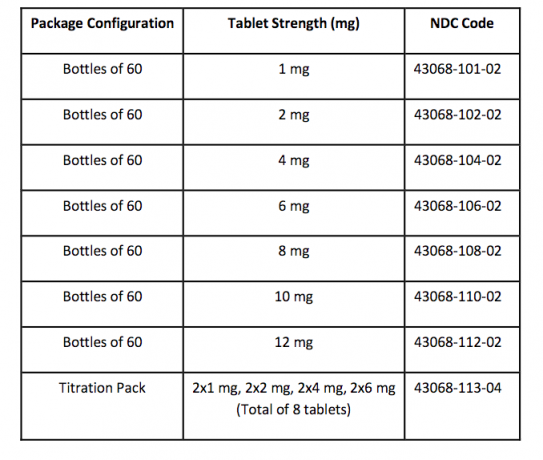
Tablete FANAPT bijele su, okrugle i poistovjećene s logotipom s jedne strane utisnutim urezanim slovima s oznakom "1", "2", "4", "6", "8", "10" ili "12". strana. Tablete se isporučuju u sljedećim jakostima i konfiguracijama paketa:
skladištenje
Čuvajte FANAPT tablete na kontroliranoj sobnoj temperaturi, 25 ° C (77 ° F); izleti dopušteni na 15 ° do 30 ° C (vidi 59 ° do 86 ° F). Zaštitite tablete FANAPT od izloženosti svjetlosti i vlazi.
INFORMACIJE O BOLESTI SAVJETOVANJA
Liječnicima se savjetuje da s pacijentima kojima propisuju FANAPT razgovaraju o sljedećim problemima:
Produženje intervala QT
Pacijente treba savjetovati da se odmah posavjetuju s liječnikom ako se osjećaju onesviješteno, izgube svijest ili palpiraju srce. Pacijentima treba savjetovati da ne uzimaju FANAPT s drugim lijekovima koji uzrokuju produljenje intervala QT. Pacijente treba obavijestiti da obavijeste liječnike da uzimaju FANAPT prije uzimanja bilo kojeg novog lijeka.
Neuroleptički maligni sindrom
Pacijentima i njegovateljima treba savjetovati da se ponekad upućuje potencijalno smrtni kompleks simptoma kao NMS prijavljeno je zajedno s primjenom antipsihotičkih lijekova, uključujući FANAPT. Znakovi i simptomi NMS-a uključuju hiperpireksiju, krutost mišića, izmijenjen mentalni status i dokaze autonomnosti
nestabilnost (nepravilan puls ili krvni tlak, tahikardija, dijaforeza i srčana disitmija).
Metaboličke promjene
Bolesnici trebaju biti svjesni simptoma hiperglikemije (visokog šećera u krvi) i dijabetes melitusa. Pacijenti kojima je dijagnosticiran dijabetes, oni s faktorima rizika za dijabetes ili oni koji ih razviju simptomi tijekom liječenja trebaju kontrolirati glukozu u krvi na početku i periodično tijekom tretman. Pacijentima treba savjetovati da je došlo do povećanja tjelesne težine tijekom liječenja FANAPT-om. Preporučuje se klinički nadzor tjelesne težine.
Ortostatska hipotenzija
Bolesnike treba upozoriti na rizik od ortostatske hipotenzije, posebno u vrijeme započinjanja liječenja, ponovnog započinjanja liječenja ili povećanja doze.
Smetnje s kognitivnim i motoričkim performansama
Budući da FANAPT može utjecati na prosuđivanje, mišljenje ili motoričke sposobnosti, treba upozoriti pacijente na njih upravljanje opasnim strojevima, uključujući automobile, sve dok nisu dovoljno sigurni da terapija FANAPT-om ne utječe na njih negativno.
Trudnoća
Savjetovati pacijente da treće tromjesečje primjene Fanapta može kod novorođenčadi izazvati ekstrapiramidne i / ili simptome odvikavanja. Savjetujte pacijentima da obavijeste svog liječnika s poznatom ili sumnjom na trudnoću.
Registar trudnica
Obavijestiti pacijente da postoji registar izloženosti trudnoći koji nadzire rezultate trudnoće kod žena koje su tijekom trudnoće izložene FANAPT-u
laktacija
Savjetujte ženama da ne doje tijekom liječenja FANAPT-om.
Istodobni lijekovi
Pacijente treba savjetovati da obavijeste svog liječnika ako uzimaju ili planiraju uzimati bilo koji lijek na recept ili bez recepta, jer postoji mogućnost interakcije.
Alkohol
Pacijente treba savjetovati da izbjegavaju alkohol dok uzimaju FANAPT.
Izloženost toplini i dehidracija
Pacijente treba savjetovati o odgovarajućoj njezi u izbjegavanju pregrijavanja i dehidracije.
Distribuira:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 SAD
Vanda i Fanapt® su registrirani zaštitni znakovi tvrtke Vanda Pharmaceuticals Inc. u Sjedinjenim Državama i drugim zemljama.
Povratak na vrh
Vodič za propisivanje Fanapt (Iloperidon) (PDF)
Podaci u ovoj monografiji nisu namijenjeni pokrivanju svih mogućih upotreba, uputa, mjera opreza, interakcija s lijekovima ili štetnih učinaka. Ovi podaci su generalizirani i nisu zamišljeni kao posebni medicinski savjeti. Ako imate pitanja o lijekovima koje uzimate ili želite više informacija, obratite se svom liječniku, ljekarniku ili medicinskoj sestri.
zadnji put ažurirano 07/13
natrag na: Web stranica farmakologije psihijatrijskih lijekova

